Glucose-6-Phosphat-Isomerase - Glucose-6-phosphate isomerase
| Glucose-6-Phosphat-Isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
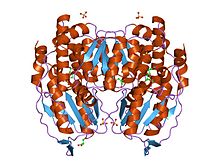
 Glucose-6-Phosphat-Isomerase-Dimer, Kaninchen
| |||||||||
| Bezeichner | |||||||||
| EG-Nr. | 5.3.1.9 | ||||||||
| CAS-Nr. | 9001-41-6 | ||||||||
| Datenbanken | |||||||||
| IntEnz | IntEnz-Ansicht | ||||||||
| BRENDA | BRENDA-Eintrag | ||||||||
| ExPASy | NiceZyme-Ansicht | ||||||||
| KEGG | KEGG-Eintrag | ||||||||
| MetaCyc | Stoffwechselweg | ||||||||
| PRIAM | Profil | ||||||||
| PDB- Strukturen | RCSB PDB PDBe PDBsum | ||||||||
| Gen-Ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Bakterielle Phosphoglucose-Isomerase C-terminale Region | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kristallstruktur der Phosphoglucose/Phosphomannose-Isomerase aus Pyrobaculum aerophilum im Komplex mit Fructose-6-Phosphat
| |||||||||
| Bezeichner | |||||||||
| Symbol | bact-PGI_C | ||||||||
| Pfam | PF10432 | ||||||||
| InterPro | IPR019490 | ||||||||
| CDD | cd05016 | ||||||||
| |||||||||
| Phosphoglucoseisomeras | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Bezeichner | |||||||||
| Symbol | g.g.A | ||||||||
| Pfam | PF00342 | ||||||||
| SCOP2 | 1pgi / Scope / SUPFAM | ||||||||
| CDD | cd05015 | ||||||||
| |||||||||
Glucose-6-Phosphat-Isomerase ( GPI ), alternativ bekannt als Phosphoglucose-Isomerase/Phosphoglucoisomerase ( PGI ) oder Phosphohexose-Isomerase ( PHI ), ist ein Enzym , das beim Menschen vom GPI- Gen auf Chromosom 19 kodiert wird. Dieses Gen kodiert für ein Mitglied der Glukosephosphat-Isomerase-Proteinfamilie. Das kodierte Protein wurde aufgrund seiner Fähigkeit, mechanistisch unterschiedliche Funktionen auszuführen, als ein Schwarzlicht-Protein identifiziert. Im Zytoplasma fungiert das Genprodukt als glykolytisches Enzym (Glucose-6-Phosphat-Isomerase), das Glucose-6-Phosphat (G6P) und Fructose-6-Phosphat (F6P) ineinander umwandelt. Extrazellulär wirkt das kodierte Protein (auch als Neuroleukin bezeichnet) als neurotropher Faktor, der das Überleben von skelettalen Motoneuronen und sensorischen Neuronen fördert, und als Lymphokin, das die Immunglobulinsekretion induziert . Das codierte Protein wird auch als autokriner Faktor Motilität (AMF) , basierend auf einer zusätzlichen Funktion als bezeichnet Tumor -secreted Zytokin und angiogene Faktor. Defekte in diesem Gen sind die Ursache einer nicht-sphärozytären hämolytischen Anämie, und ein schwerer Enzymmangel kann mit Hydrops fetalis, sofortigem Tod des Neugeborenen und neurologischen Beeinträchtigungen einhergehen. Alternatives Spleißen führt zu mehreren Transkriptvarianten. [bereitgestellt von RefSeq, Januar 2014]
Struktur
Funktionelles GPI ist ein 64-kDa-Dimer, das aus zwei identischen Monomeren besteht. Die beiden Monomere interagieren insbesondere durch die beiden Vorsprünge in einer umarmenden Umarmung. Das aktive Zentrum jedes Monomers wird durch eine Spalte zwischen den beiden Domänen und der Dimer-Grenzfläche gebildet.
GPI-Monomere bestehen aus zwei Domänen, einer besteht aus zwei separaten Segmenten, die als große Domäne bezeichnet werden, und die andere besteht aus dem dazwischen liegenden Segment, das als kleine Domäne bezeichnet wird. Die beiden Domänen sind jeweils αβα-Sandwiches, wobei die kleine Domäne ein fünfsträngiges β-Faltblatt enthält, das von α-Helices umgeben ist, während die große Domäne ein sechssträngiges β-Faltblatt aufweist. Die große Domäne, die sich am N-Terminus befindet , und der C-Terminus jedes Monomers enthalten auch "armartige" Vorsprünge. Mehrere Reste in der kleinen Domäne dienen der Phosphatbindung, während andere Reste, insbesondere His 388 , aus den großen und C-terminalen Domänen entscheidend für den durch dieses Enzym katalysierten Zuckerringöffnungsschritt sind. Da die Isomerisierungsaktivität an der Dimergrenzfläche auftritt, ist die Dimerstruktur dieses Enzyms für seine katalytische Funktion entscheidend.
Es wird vermutet, dass die Serinphosphorylierung dieses Proteins eine Konformationsänderung seiner sekretorischen Form induziert.
Mechanismus
Der Mechanismus, den GPI verwendet, um Glucose-6-Phosphat und Fructose-6-Phosphat (Aldose zu Ketose) ineinander umzuwandeln, besteht aus drei Hauptschritten: Öffnen des Glucoserings, Isomerisieren von Glucose in Fructose durch ein Endiol-Zwischenprodukt und Schließen des Fructoserings.
Isomerisierung von Glucose
| D - Glukose | Phosphoglucose-Isomerase | D - Fruktose | |

|

|
||

|
|||
| Phosphoglucose-Isomerase | |||
| α- D - Glucose-6-phosphat | Phosphoglucose-Isomerase | α- D - Fructose-6-phosphat | |

|

|
||

|
|||
| Phosphoglucose-Isomerase | |||
Verbindung C00668 in der KEGG Pathway Database. Enzym 5.3.1.9 in der KEGG Pathway Database. Verbindung C05345 in der KEGG Pathway Database. Reaktion R00771 in der KEGG Pathway Database.
Glucose-6-phosphat bindet an GPI in seiner Pyranoseform. Der Ring wird in einem "Push-Pull"-Mechanismus durch His388, das den C5-Sauerstoff protoniert, und Lys518, das die C1-Hydroxylgruppe deprotoniert, geöffnet. Dadurch entsteht eine Aldose mit offener Kette. Dann wird das Substrat um die C3-C4-Bindung gedreht, um es für die Isomerisierung zu positionieren. An diesem Punkt deprotoniert Glu357 C2, um ein durch Arg272 stabilisiertes cis- Endiolat-Zwischenprodukt zu erzeugen. Zur Vervollständigung der Isomerisierung gibt Glu357 sein Proton an C1 ab, die C2-Hydroxylgruppe verliert ihr Proton und es entsteht die offenkettige Ketose-Fructose-6-Phosphat. Schließlich wird der Ring geschlossen, indem das Substrat erneut um die C3-C4-Bindung rotiert und das C5-Hydroxyl mit Lys518 deprotoniert wird.
Funktion
Dieses Gen gehört zur GPI-Familie. Das von diesem Gen kodierte Protein ist ein dimeres Enzym, das die reversible Isomerisierung von G6P und F6P katalysiert. Da die Reaktion reversibel ist, wird ihre Richtung durch die G6P- und F6P-Konzentrationen bestimmt.
Glucose-6-Phosphat ↔ Fructose-6-Phosphat
Das Protein hat unterschiedliche Funktionen innerhalb und außerhalb der Zelle. Im Zytoplasma ist das Protein an der Glykolyse und Gluconeogenese sowie am Pentosephosphatweg beteiligt. Außerhalb der Zelle fungiert es als neurotropher Faktor für spinale und sensorische Neuronen, Neuroleukin genannt . Das gleiche Protein wird auch von Krebszellen sezerniert , wo es als autokriner Motilitätsfaktor bezeichnet wird und die Metastasierung stimuliert . Es ist auch bekannt, dass extrazellulärer GPI als Reifungsfaktor fungiert.
Neuroleukin
Obwohl sie ursprünglich als separate Proteine behandelt wurden, zeigte die Klonierungstechnologie, dass GPI fast identisch mit dem Protein Neuroleukin ist . Neuroleukin ist ein neurotropher Faktor für spinale und sensorische Neuronen. Es kommt in großen Mengen in Muskeln, Gehirn, Herz und Nieren vor. Neuroleukin wirkt auch als Lymphokin, das von T-Zellen sezerniert wird, die durch Lektin stimuliert werden. Es induziert die Immunglobulin-Sekretion in B-Zellen als Teil einer Reaktion, die Antikörper-sezernierende Zellen aktiviert.
Autokriner Motilitätsfaktor
Klonierungsexperimente zeigten auch, dass GPI mit dem Protein identisch ist, das als autokriner Motilitätsfaktor (AMF) bekannt ist. AMF wird von Krebszellen produziert und sezerniert und stimuliert als Wachstumsfaktor das Zellwachstum und die Motilität . Es wird angenommen, dass AMF eine Schlüsselrolle bei der Krebsmetastasierung spielt, indem es die MAPK / ERK- oder PI3K / AKT- Signalwege aktiviert. Im PI3K/AKT-Weg interagiert AMF mit gp78/ AMFR, um die ER- Kalziumfreisetzung zu regulieren und somit vor Apoptose als Reaktion auf ER-Stress zu schützen .
Prokaryontische bifunktionelle Glucose-6-Phosphat-Isomerase
Bei einigen Archaeen und Bakterien erfolgt die Glucose-6-Phosphat-Isomerase-Aktivität über ein bifunktionelles Enzym , das auch Phosphomannose-Isomerase (PMI)-Aktivität aufweist. Obwohl es nicht eng mit eukaryotischen GPIs verwandt ist, ist das bifunktionelle Enzym ähnlich genug, dass die Sequenz den Cluster von Threoninen und Serinen umfasst , die die Zuckerphosphat-Bindungsstelle in herkömmlichen GPI bilden. Es wird angenommen, dass das Enzym die gleichen katalytischen Mechanismen sowohl für die Glucoseringöffnung als auch für die Isomerisierung für die Umwandlung von G6P in F6P verwendet.
Klinische Bedeutung
Ein GPI-Mangel ist für 4% der hämolytischen Anämien aufgrund von glykolytischen Enzymdefekten verantwortlich. In letzter Zeit wurden mehrere Fälle von GPI-Mangel festgestellt.
Erhöhte Serum-GPI-Spiegel wurden als prognostischer Biomarker für Kolorektal- , Brust- , Lungen- , Nieren- , Magen-Darm- und andere Krebsarten verwendet . Als AMF wird GPI die Regulierung der Zellmigration während der Invasion und Metastasierung zugeschrieben . Eine Studie zeigte, dass die äußeren Schichten von Brusttumorsphäroiden (BTS) GPI sezernieren, das bei BTS den epithelial-mesenchymalen Übergang (EMT), die Invasion und die Metastasierung induziert . Es wurde festgestellt, dass die GPI-Inhibitoren ERI4P und 6PG die Metastasierung von BTS blockieren, jedoch nicht die BTS-Glykolyse oder die Lebensfähigkeit von Fibroblasten. Außerdem wird GPI ausschließlich von Tumorzellen und nicht von normalen Zellen sezerniert. Aus diesen Gründen können GPI-Hemmer ein sichererer und gezielterer Ansatz für die Krebstherapie sein. GPI nimmt auch an einer positiven Rückkopplungsschleife mit HER2 teil , einem wichtigen therapeutischen Ziel von Brustkrebs, da GPI die HER2-Expression und die HER2-Überexpression die GPI-Expression erhöht und so weiter. Infolgedessen verleiht die GPI-Aktivität Brustkrebszellen wahrscheinlich eine Resistenz gegen HER2-basierte Therapien mit Herceptin /Trastuzumab und sollte als zusätzliches Ziel bei der Behandlung von Patientinnen in Betracht gezogen werden.
Siehe auch
- Fructose-1-Phosphat-Aldolase- Enzym, das Fructose in Glucose umwandelt
Interaktionen
Es ist bekannt, dass GPI mit Folgendem interagiert :
Interaktiver Wegplan
Klicken Sie unten auf Gene, Proteine und Metaboliten, um zu den entsprechenden Artikeln zu verlinken.
Verweise
Weiterlesen
- Walker JI, Faik P, Morgan MJ (1990). „Charakterisierung des 5'-Endes des Gens für die menschliche Glucosephosphat-Isomerase (GPI)“. Genomik . 7 (4): 638–43. doi : 10.1016/0888-7543(90)90212-D . PMID 2387591 .
- Brownstein BH, Silverman GA, Little RD, et al. (1989). „Isolierung von Einzelkopie-menschlichen Genen aus einer Bibliothek von Hefe-Klonen künstlicher Chromosomen“. Wissenschaft . 244 (4910): 1348–51. Bibcode : 1989Sci...244.1348B . doi : 10.1126/science.2544027 . PMID 2544027 .
- Mizrachi Y (1989). „Neurotrophe Aktivität der monomeren Glucophosphoisomerase wurde durch das humane Immunschwächevirus (HIV-1) und Peptide des HIV-1-Hüllglykoproteins blockiert“. J. Neurosci. Res . 23 (2): 217–24. doi : 10.1002/jnr.490230212 . PMID 2547084 . S2CID 42567893 .
- Gurney ME, Apatoff BR, Spear GT et al. (1986). „Neuroleukin: ein Lymphokinprodukt von Lektin-stimulierten T-Zellen“. Wissenschaft . 234 (4776): 574–81. Bibcode : 1986Sci...234..574G . doi : 10.1126/science.3020690 . PMID 3020690 .
- Faik P, Walker JI, Redmill AA, Morgan MJ (1988). "Maus-Glucose-6-Phosphat-Isomerase und Neuroleukin haben identische 3'-Sequenzen". Natur . 332 (6163): 455–7. Bibcode : 1988Natur.332..455F . doi : 10.1038/332455a0 . PMID 3352745 . S2CID 4306026 .
- Zanella A, Izzo C, Rebulla P, et al. (1981). „Die erste stabile Variante der Erythrozyten-Glucose-Phosphat-Isomerase im Zusammenhang mit schwerer hämolytischer Anämie“. Bin. J. Hämatol . 9 (1): 1–11. doi : 10.1002/ajh.2830090102 . PMID 7435496 . S2CID 10479146 .
- Faik P, Walker JI, Morgan MJ (1994). „Identifizierung einer neuen tandemly wiederholten Sequenz, die in einem Intron des Glucosephosphatisomerase (GPI)-Gens in Maus und Mensch vorhanden ist“. Genomik . 21 (1): 122–7. doi : 10.1006/geno.1994.1233 . PMID 7545951 .
- Xu W., Beutler E. (1995). "Die Charakterisierung von Genmutationen für den Mangel an menschlicher Glucosephosphatisomerase im Zusammenhang mit chronischer hämolytischer Anämie" . J. Clin. Investieren . 94 (6): 2326–9. doi : 10.1172/JCI117597 . PMC 330061 . PMID 7989588 .
- W. Xu, P. Lee, E. Beutler (1996). „Menschliche Glucosephosphat-Isomerase: Exon-Mapping und Genstruktur“. Genomik . 29 (3): 732–9. doi : 10.1006/geno.1995.9944 . PMID 8575767 .
- Baronciani L, Zanella A, Bianchi P, et al. (1996). "Studie der molekularen Defekte bei Patienten mit Glucosephosphat-Isomerase-Mangel, die von chronischer hämolytischer Anämie betroffen sind" . Blut . 88 (6): 2306–10. doi : 10.1182/blood.V88.6.2306.bloodjournal8862306 . PMID 8822952 .
- E. Beutler, C. West, HA. Britton et al. (1998). „Glucosephosphat-Isomerase (GPI)-Mangel-Mutationen im Zusammenhang mit hereditärer nicht-sphärozytärer hämolytischer Anämie (HNSHA)“. Blutkörperchen Mol. Dis . 23 (3): 402–9. doi : 10.1006/bcmd.1997.0157 . PMID 9446754 .
- Kanno H, Fujii H, Miwa S (1998). „Expression und enzymatische Charakterisierung von Varianten der menschlichen Glucosephosphat-Isomerase (GPI), die für GPI-Mangel verantwortlich sind“. Blutkörperchen Mol. Dis . 24 (1): 54–61. doi : 10.1006/bcmd.1998.0170 . PMID 9616041 .
- Kugler W, Breme K, Laspe P, et al. (1998). „Molekulare Grundlage der neurologischen Dysfunktion gekoppelt mit hämolytischer Anämie bei menschlichem Glucose-6-Phosphat-Isomerase (GPI)-Mangel“. Summen. Genet . 103 (4): 450–4. doi : 10.1007/s004390050849 . PMID 9856489 . S2CID 8313584 .
- Belyaeva OV, Balanovsky OP, Ashworth LK et al. (1999). „Feinkartierung eines polymorphen CA-Wiederholungsmarkers auf dem menschlichen Chromosom 19 und seine Verwendung in Bevölkerungsstudien“. Gene . 230 (2): 259–66. doi : 10.1016/S0378-1119(99)00056-6 . PMID 10216265 .
- Yakirevich E, Naot Y (2000). "Klonierung eines Glukosephosphat-Isomerase/Neuroleukin-ähnlichen Spermien-Antigens, das an der Spermien-Agglutination beteiligt ist" . Biol. Repro . 62 (4): 1016–23. doi : 10.1095/biolreprod62.4.1016 . PMID 10727272 .
- Haga A, Niinaka Y, Raz A (2000). „Phosphohexose-Isomerase/autokriner Motilitätsfaktor/Neuroleukin/Reifungsfaktor ist ein multifunktionales Phosphoprotein“. Biochim. Biophys. Akta . 1480 (1–2): 235–44. doi : 10.1016/s0167-4838(00)00075-3 . PMID 11004567 .
















