Blei (II) -nitrat - Lead(II) nitrate
|
|
|||
| Eigenschaften | |||
|---|---|---|---|
| Pb (NO 3 ) 2 | |||
| Molmasse | 331,2 g / mol | ||
| Aussehen | farblos oder weiß | ||
| Dichte | 4,53 g / cm 3 | ||
| Schmelzpunkt | zersetzt sich | ||
| 376,5 g / l (0 ° C) 597 g / l (25 ° C) 1270 g / l (100 ° C) |
|||
| Gefahren | |||
| Sicherheitsdatenblatt | ICSC 1000 | ||
|
EU-Klassifizierung (DSD) (veraltet)
|
Repr. Katze. 1/3 Giftig ( T ) Schädlich ( Xn ) Umweltgefährlich ( N ) |
||
| NFPA 704 (Feuerdiamant) | |||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
|
LD Lo ( niedrigste Veröffentlichung )
|
500 mg / kg (Meerschweinchen, oral) | ||
|
Sofern nicht anders angegeben, werden Daten für Materialien in ihrem Standardzustand (bei 25 ° C, 100 kPa) angegeben. |
|||
| Infobox-Referenzen | |||
Blei (II) -nitrat ist eine anorganische Verbindung mit der chemischen Formel Pb ( NO 3 ) 2 . Sie tritt häufig als farblosen Kristall oder weißes Pulver und, im Gegensatz zu den meisten anderen Blei (II) Salze , ist löslich in Wasser .
Seit dem Mittelalter unter dem Namen Plumbum Dulce bekannt , war die Herstellung von Blei (II) -nitrat aus metallischem Blei oder Bleioxid in Salpetersäure im kleinen Maßstab zur direkten Verwendung bei der Herstellung anderer Bleiverbindungen . Im neunzehnten Jahrhundert begann die kommerzielle Herstellung von Blei (II) -nitrat in Europa und den Vereinigten Staaten. Historisch gesehen war die Hauptverwendung ein Rohstoff bei der Herstellung von Pigmenten für Bleifarben , aber solche Farben wurden durch weniger toxische Farben auf Titandioxidbasis ersetzt . Andere industrielle Verwendungen eingeschlossen Wärmestabilisierung in Nylon und Polyester , und in Beschichtungen von photothermographisches Papier. Seit etwa dem Jahr 2000 wird Blei (II) -nitrat bei der Goldcyanidierung eingesetzt .
Blei (II) -nitrat ist giftig und muss mit Vorsicht behandelt werden, um Einatmen, Verschlucken und Hautkontakt zu verhindern. Aufgrund seiner Gefährlichkeit werden die begrenzten Anwendungen von Blei (II) -nitrat ständig überprüft.
Geschichte
Bleinitrat wurde erstmals 1597 vom Alchemisten Andreas Libavius identifiziert , der die Substanz Plumbum Dulce wegen ihres Geschmacks "süßes Blei" nannte. Es wird kommerziell durch Reaktion von metallischem Blei mit konzentrierter Salpetersäure hergestellt, in der es schwer löslich ist. Es wurde als Rohstoff für die Herstellung von Pigmenten wie Chromgelb (Blei (II) -chromat, PbCrO 4 ) und Chromorange (basisches Blei (II) -chromat, Pb 2 CrO 5 ) und Neapelgelb hergestellt . Diese Pigmente wurden zum Färben und Bedrucken von Kaliko und anderen Textilien verwendet. Es wurde als Oxidationsmittel in Schwarzpulver und zusammen mit Bleiazid in speziellen Sprengstoffen verwendet .
Produktion
Bleinitrat entsteht durch Reaktion von Blei (II) oxid mit konzentrierter Salpetersäure:
- PbO + 2 HNO 3 (konzentriert) → Pb (NO 3 ) 2 ↓ + H 2 O.
Es kann auch eine Verdampfung der Lösung erhalten werden, die durch Umsetzen von metallischem Blei mit verdünnter Salpetersäure erhalten wird .
- Pb + 4 HNO 3 → Pb (NO 3 ) 2 + 2 NO 2 + 2 H 2 O.
Bei der Verarbeitung von Blei- Wismut- Abfällen aus Blei-Raffinerien entstehen Lösungen und Kristalle von Blei (II) -nitrat .
Struktur
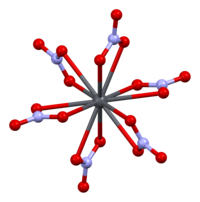
Die Kristallstruktur von festem Blei (II) -nitrat wurde durch Neutronenbeugung bestimmt . Die Verbindung kristallisiert im kubischen System mit den Bleiatomen in einem flächenzentrierten kubischen System. Seine Raumgruppe ist Pa3 Z = 4 ( Bravais-Gitternotation ), wobei jede Seite des Würfels eine Länge von 784 Pikometern hat .
Die schwarzen Punkte repräsentieren die Bleiatome, die weißen Punkte die Nitratgruppen 27 Pikometer über der Ebene der Bleiatome und die blauen Punkte die Nitratgruppen im gleichen Abstand unterhalb dieser Ebene. In dieser Konfiguration wird jedes Bleiatom gebunden zu zwölf Sauerstoffatomen ( Bindungslänge : 281 pm). Alle NO-Bindungslängen sind mit 127 Pikometern identisch.
Das Forschungsinteresse an der Kristallstruktur von Blei (II) -nitrat beruhte teilweise auf der Möglichkeit einer freien Innenrotation der Nitratgruppen innerhalb des Kristallgitters bei erhöhten Temperaturen, was jedoch nicht eintrat.
Chemische Eigenschaften und Reaktionen
Bleinitrat zersetzt sich beim Erhitzen, eine Eigenschaft, die in der Pyrotechnik verwendet wurde . Es ist wasserlöslich und verdünnt Salpetersäure.
Basische Nitrate entstehen, wenn einer Lösung Alkali zugesetzt wird. Pb 2 (OH) 2 (NO 3 ) 2 ist die vorherrschende Spezies, die bei niedrigem pH gebildet wird. Bei höherem pH wird Pb 6 (OH) 5 (NO 3 ) gebildet. Das Kation [Pb 6 O (OH) 6 ] 4+ weist ungewöhnlich ein Oxidion in einem Cluster von 3 PbO 4 -Tetraedern auf, die sich die Fläche teilen . Es gibt keine Hinweise auf die Bildung des Hydroxids Pb (OH) 2 in wässriger Lösung unter pH 12.
Lösungen von Bleinitrat können verwendet werden, um Koordinationskomplexe zu bilden. Blei (II) ist ein harter Akzeptor ; es bildet stärkere Komplexe mit elektronenspendenden Stickstoff- und Sauerstoffliganden . Beispielsweise ergab die Kombination von Bleinitrat und Pentaethylenglykol (EO 5 ) in einer Lösung von Acetonitril und Methanol, gefolgt von langsamer Verdampfung , die Verbindung [Pb (NO 3 ) 2 (EO 5 )]. In der Kristallstruktur für diese Verbindung ist die EO 5 -Kette in einer Äquatorialebene ähnlich der eines Kronenethers um das Bleiion gewickelt . Die zwei zweizähnigen Nitratliganden befinden sich in trans-Konfiguration . Die Gesamtkoordinationszahl beträgt 10, wobei sich das Bleiion in einer molekularen Geometrie mit doppeltem quadratischem Antiprisma befindet .
Der durch Bleinitrat mit einem zweizähnigen Bithiazol- N-Donor-Liganden gebildete Komplex ist zweikernig. Die Kristallstruktur zeigt, dass die Nitratgruppe eine Brücke zwischen zwei Bleiatomen bildet. Ein interessanter Aspekt dieser Art von Komplexen ist das Vorhandensein einer physikalischen Lücke in der Koordinationssphäre ; dh die Liganden sind nicht symmetrisch um das Metallion angeordnet. Dies ist möglicherweise auf ein einzelnes Blei- Elektronenpaar zurückzuführen, das auch in Bleikomplexen mit einem Imidazolliganden gefunden wird .
Anwendungen
Bleinitrat wurde als Wärmestabilisator in Nylon und Polyestern, als Beschichtung für photothermographisches Papier und in Rodentiziden verwendet .
Das Erhitzen von Bleinitrat ist ein bequemes Mittel zur Herstellung von Stickstoffdioxid
- 2 Pb (NO 3 ) 2 → 2 PbO + 4 NO 2 + O 2
Beim Goldcyanidierungsprozess verbessert die Zugabe von Blei (II) -nitratlösung den Auslaugungsprozess . Es sind nur begrenzte Mengen (10 bis 100 Milligramm Bleinitrat pro Kilogramm Gold) erforderlich.
In der organischen Chemie kann es zur Herstellung von Isothiocyanaten aus Dithiocarbamaten verwendet werden . Seine Verwendung als Bromid Scavenger während S N 1 - Substitution wird berichtet.
Sicherheit
Blei (II) -nitrat ist toxisch und die Einnahme kann zu einer akuten Bleivergiftung führen, wie dies für alle löslichen Bleiverbindungen gilt. Alle anorganischen Bleiverbindungen werden von der Internationalen Agentur für Krebsforschung (IARC) als wahrscheinlich krebserzeugend für den Menschen eingestuft (Kategorie 2A). Sie wurden mit Nierenkrebs und Gliom bei Versuchstieren sowie mit Nierenkrebs, Hirntumor und Lungenkrebs beim Menschen in Verbindung gebracht, obwohl Studien an Arbeitern, die Blei ausgesetzt waren, häufig durch gleichzeitige Exposition gegenüber Arsen erschwert werden . Es ist bekannt, dass Blei Zink in einer Reihe von Enzymen ersetzt , einschließlich δ-Aminolevulinsäuredehydratase (Porphobilinogensynthase) im Häm- Biosyntheseweg und Pyrimidin-5'-Nucleotidase , die für den korrekten DNA- Metabolismus wichtig sind und daher fetale Schäden verursachen können.
Verweise
Externe Links
- Woodbury, William D. (1982). "Blei" . Mineral Jahrbuch Metalle und Mineralien . Bureau of Mines : 515–42 . Abgerufen am 18.01.2008 .
- "Blei" . NIOSH Pocket Guide für chemische Gefahren . Nationales Institut für Arbeitssicherheit und Gesundheit. September 2005. NIOSH 2005-149 . Abgerufen am 19.01.2008 .
- "Fact Sheet zu Blei und Bleiverbindungen" . Nationales Schadstoffinventar . Australische Regierung, Ministerium für Umwelt und Wasserressourcen. Juli 2007. Aus dem Original am 11. Januar 2008 archiviert . Abgerufen am 19.01.2008 .
- "Blei" . Eine gesunde häusliche Umgebung, Gesundheitsgefahren . US-Allianz für ein gesundes Zuhause. Archiviert vom Original am 20.02.2008 . Abgerufen am 19.01.2008 .
- Produktsicherheitsdokumente
- Sicherheitsdatenblatt für Bleinitrat, PTCL, Universität Oxford
- Sicherheitsdatenblatt für Bleinitrat, Science Stuff Inc.
- Sicherheitsdatenblatt für Bleinitrat, Iowa State University