Hereditäre Sphärozytose - Hereditary spherocytosis
| Hereditäre Sphärozytose | |
|---|---|
| Andere Namen | Minkowski-Chauffard-Syndrom |
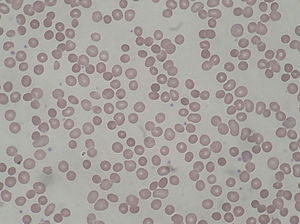 | |
| Peripherer Blutausstrich von Patienten mit hereditärer Sphärozytose | |
| Spezialität | Hämatologie |
Hereditäre Sphärozytose ist eine Anomalie der roten Blutkörperchen oder Erythrozyten . Es ist eine chronische Krankheit ohne Heilung. Die Störung wird durch Mutationen in Genen verursacht, die sich auf Membranproteine beziehen, die es den Erythrozyten ermöglichen, ihre Form zu ändern. Die abnormen Erythrozyten sind eher kugelförmig ( Sphärozytose ) als die normale bikonkave Scheibenform. Dysfunktionale Membranproteine beeinträchtigen die Fähigkeit der Zelle, flexibel von den Arterien zu den kleineren Kapillaren zu gelangen . Dieser Formunterschied macht die roten Blutkörperchen auch anfälliger für Rupturen . Zellen mit diesen dysfunktionalen Proteinen werden in der Milz abgebaut . Dieser Mangel an Erythrozyten führt zu einer hämolytischen Anämie .
Es wurde erstmals 1871 beschrieben. Es ist die häufigste Ursache für erbliche Hämolyse in europäischen und nordamerikanischen kaukasischen Bevölkerungen mit einer Inzidenz von 1 von 5000 Geburten. Der klinische Schweregrad von HS variiert von symptomfreiem Träger bis hin zu schwerer Hämolyse, da die Erkrankung eine unvollständige Penetranz in ihrer Ausprägung aufweist .
Symptome sind Anämie, Gelbsucht, Splenomegalie und Müdigkeit . Darüber hinaus sammelt sich der Detritus der abgebauten Blutkörperchen – unkonjugiertes oder indirektes Bilirubin – in der Gallenblase an und kann zu pigmentierten Gallensteinen führen . Bei chronischen Patienten kann eine Infektion oder eine andere Krankheit zu einer verstärkten Zerstörung der roten Blutkörperchen führen, was zu akuten Symptomen, einer hämolytischen Krise, führt . Auf einem Blutausstrich können Howell-Jolly-Körperchen in den roten Blutkörperchen gesehen werden. Die primäre Behandlung von Patienten mit symptomatischer HS war die totale Splenektomie , die den hämolytischen Prozess eliminiert und normale Hämoglobin- , Retikulozyten- und Bilirubinspiegel ermöglicht . Sphärozytose-Patienten, die für ein Hämochromatose- Gen heterozygot sind, können an einer Eisenüberladung leiden, obwohl die Hämochromatose-Gene rezessiv sind.
Akute Fälle können drohen, Hypoxie durch Anämie und akuter Kernikterus durch hohe Bilirubinspiegel im Blut zu verursachen, insbesondere bei Neugeborenen. Die meisten Fälle können kurz nach der Geburt erkannt werden. Ein Erwachsener mit dieser Krankheit sollte seine Kinder testen lassen, obwohl das Vorhandensein der Krankheit bei Kindern normalerweise kurz nach der Geburt bemerkt wird. Gelegentlich bleibt die Krankheit unbemerkt, bis das Kind etwa 4 oder 5 Jahre alt ist. Eine Person kann auch ein Träger der Krankheit sein und keine Anzeichen oder Symptome der Krankheit zeigen. Andere Symptome können Bauchschmerzen sein, die zur Entfernung der Milz und/oder der Gallenblase führen können.
Präsentation
Komplikationen
- Hämolytische Krise mit ausgeprägterer Gelbsucht aufgrund einer beschleunigten Hämolyse (kann durch eine Infektion ausgelöst werden).
- Aplastische Krise mit dramatischem Abfall des Hämoglobinspiegels und (Retikulozytenzahl)-Dekompensation, meist aufgrund von Reifungsstillstand und oft verbunden mit megaloblastären Veränderungen; kann durch Infektionen, wie Influenza, insbesondere mit Parvovirus B19, ausgelöst werden .
- Folatmangel durch erhöhten Knochenmarkbedarf.
- Pigmentierte Gallensteine treten bei etwa der Hälfte der unbehandelten Patienten auf. Eine erhöhte Hämolyse der roten Blutkörperchen führt zu einem erhöhten Bilirubinspiegel, da Bilirubin ein Abbauprodukt von Häm ist . Der hohe Bilirubinspiegel muss über die Leber in die Galle ausgeschieden werden, was zur Bildung eines pigmentierten Gallensteins führen kann, der aus Calciumbilirubinat besteht. Da diese Steine einen hohen Gehalt an Kalziumkarbonat und Phosphat enthalten, sind sie röntgendicht und auf Röntgenbildern sichtbar.
- Beingeschwür.
- Abnormal niedrige Hämoglobin A1C- Werte. Hämoglobin A1C (glykiertes Hämoglobin) ist ein Test zur Bestimmung des durchschnittlichen Blutzuckerspiegels über einen längeren Zeitraum und wird häufig zur Beurteilung der Blutzuckerkontrolle bei Diabetikern verwendet. Die Hämoglobin-A1C-Werte sind ungewöhnlich niedrig, da die Lebensdauer der roten Blutkörperchen verkürzt wird, wodurch weniger Zeit für die nicht-enzymatische Glykosylierung von Hämoglobin bleibt. Somit wird der A1C selbst bei hohem Gesamtblutzucker niedriger sein als erwartet.
Pathophysiologie
Die hereditäre Sphärozytose kann autosomal-rezessiv oder autosomal-dominant vererbt sein. Die hereditäre Sphärozytose wird am häufigsten (wenn auch nicht ausschließlich) in nordeuropäischen und japanischen Familien gefunden, obwohl schätzungsweise 25 % der Fälle auf spontane Mutationen zurückzuführen sind . Ein Patient hat eine Chance von 50 %, die Mutation an jeden seiner Nachkommen weiterzugeben.
Die hereditäre Sphärozytose wird durch eine Vielzahl von molekularen Defekten in den Genen verursacht, die für die Proteine der roten Blutkörperchen Spektrin ( Alpha und Beta ), Ankyrin , Band-3- Protein, Protein 4.2 und andere Membranproteine der roten Blutkörperchen kodieren:
| Typ | OMIM | Gen | Ort |
|---|---|---|---|
| HS1 | 182900 | ANK1 | 8p11.2 |
| HS2 | 182870 | SPTB | 14q22-q23 |
| HS3 | 270970 | SPTA | 1q21 |
| HS4 | 612653 | SLC4A1 | 17q21-q22 |
| HS5 | 612690 | EPB42 | 15q15 |
Diese Proteine sind notwendig, um die normale Form eines roten Blutkörperchens, einer bikonkaven Scheibe, beizubehalten. Das am häufigsten defekte integrierende Protein ist Spektrin, das für den Einbau und die Bindung von Spektrin verantwortlich ist, so dass bei seiner Dysfunktion Zytoskelett-Instabilitäten entstehen.
Der Hauptdefekt der hereditären Sphärozytose ist ein Mangel an Membranoberfläche. 1) Defekte von Spektrin, Ankyrin (am häufigsten) oder Protein 4.2 führen zu verminderter Dichte des Membranskelett, der darüber liegenden Lipiddoppelschicht zu destabilisieren und Loslassen: abnehmend Oberfläche kann durch zwei verschiedene Mechanismen erzeugt werden , Band 3 -haltigen Mikrovesikel . 2) Defekte von Band 3 führen zu Band-3-Mangel und Verlust seiner lipidstabilisierenden Wirkung. Dies führt zum Verlust von Band-3-freien Mikrovesikeln. Beide Wege führen zu Membranverlust, verringerter Oberfläche und Bildung von Sphärozyten mit verringerter Verformbarkeit.
Da die Milz normalerweise auf abnorm geformte rote Blutkörperchen (die typischerweise älter sind) zielt, zerstört sie auch Sphäroozyten. In der Milz kann der Übergang von den Billroth-Schnüren in die Sinusoide als Flaschenhals angesehen werden, wo rote Blutkörperchen flexibel sein müssen, um durchzukommen. Bei der hereditären Sphärozytose können rote Blutkörperchen nicht passieren und werden phagozytiert, was eine extravaskuläre Hämolyse verursacht .
Diagnose
In einem Blutausstrichevaluation , die roten Blutkörperchen werden erscheinen ungewöhnlich klein und es fehlen sie den zentralen blass Bereich, der in normalen roten Blutkörperchen vorhanden ist. Diese Veränderungen werden auch bei nicht-hereditärer Sphärozytose beobachtet, sind jedoch typischerweise bei hereditärer Sphärozytose ausgeprägter. Die Zahl der unreifen roten Blutkörperchen ( Retikulozytenzahl ) wird erhöht. Ein Anstieg der mittleren korpuskulären Hämoglobinkonzentration steht auch im Einklang mit einer hereditären Sphärozytose.
Andere Proteinmängel verursachen erbliche Elliptozytose , Pyropoikilozytose oder Stomatozytose .
In langjährigen Fällen und bei Patienten , die genommen haben Eisen - Supplementierung oder zahlreichen erhalten Bluttransfusionen , Eisenüberladung kann ein erhebliches Problem. Dies ist eine mögliche Ursache für Herzmuskelschäden und Lebererkrankungen . Die Messung der Eisenspeicher gilt daher als Teil der Diagnostik der hereditären Sphärozytose.
Ein osmotischer Fragilitätstest kann bei der Diagnose helfen. Bei diesem Test platzen die Sphärozyten in flüssigen Lösungen, die weniger konzentriert sind als das Innere der roten Blutkörperchen. Dies ist auf eine erhöhte Durchlässigkeit der Sphärozytmembran für Salz und Wasser zurückzuführen, das in die konzentrierte innere Umgebung der Erythrozyten eindringt und zu deren Ruptur führt. Obwohl der osmotische Fragilitätstest weithin als der Goldstandard für die Diagnose einer hereditären Sphärozytose gilt, verfehlt er bis zu 25 % der Fälle. Die durchflusszytometrische Analyse von Eosin-5′-Maleimid-markierten intakten roten Blutkörperchen und der Lysetest auf angesäuertes Glycerin sind zwei weitere Optionen zur Unterstützung der Diagnose.
Behandlung
Obwohl die Forschung im Gange ist, gibt es derzeit keine Heilung für den genetischen Defekt, der die hereditäre Sphärozytose verursacht. Das derzeitige Management konzentriert sich auf Interventionen, die den Schweregrad der Krankheit begrenzen. Behandlungsmöglichkeiten umfassen:
- Splenektomie : Wie bei der nicht hereditären Sphärozytose weisen akute Anämie- und Hyperbilirubinämie- Symptome auf eine Behandlung mit Bluttransfusionen oder Blutaustausch hin und chronische Symptome einer Anämie und eine vergrößerte Milz weisen auf eine Nahrungsergänzung mit Folsäure und eine Splenektomie , die chirurgische Entfernung der Milz, hin. Eine Splenektomie ist für mittelschwere bis schwere Fälle indiziert, jedoch nicht für leichte Fälle. Um das Risiko einer Sepsis zu verringern , benötigen Patienten mit Splenektomie eine Immunisierung gegen das Influenzavirus , eingekapselte Bakterien wie Streptococcus pneumoniae und Meningococcus sowie eine prophylaktische Antibiotikabehandlung. Der Einsatz prophylaktischer Antibiotika wie Penicillin bleibt jedoch umstritten.
- Partielle Splenektomie : Da die Milz für den Schutz vor eingekapselten Organismen wichtig ist, ist eine durch eingekapselte Organismen verursachte Sepsis eine mögliche Komplikation der Splenektomie. Die Möglichkeit der partiellen Splenektomie kann im Interesse der Erhaltung der Immunfunktion in Betracht gezogen werden. Die Ergebnisforschung ist derzeit begrenzt, aber günstig.
- Eventuell muss die Gallenblase operativ entfernt werden.
Epidemiologie
Die hereditäre Sphärozytose ist die häufigste Erkrankung der Erythrozytenmembran und betrifft 1 von 2.000 Menschen nordeuropäischer Abstammung. Nach Harrisons Principles of Internal Medicine liegt die Häufigkeit bei mindestens 1 zu 5.000.
Forschung
Es existiert eine experimentelle Gentherapie zur Behandlung der erblichen Sphärozytose bei Labormäusen; diese Behandlung wurde jedoch aufgrund aller Risiken, die mit der Humangentherapie verbunden sind, noch nicht am Menschen ausprobiert.
Siehe auch
Verweise
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |
