Aprotinin - Aprotinin
 | |
| Klinische Daten | |
|---|---|
| Andere Namen | Trasylol, Rinderpankreastrypsin-Inhibitor |
| AHFS / Drugs.com | Monographie |
| Schwangerschaft Kategorie |
|
| Dependence Haftung |
Keiner |
| Wege Verwaltung |
Intravenös |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | 100% ( intravenös ) |
| Identifikatoren | |
| |
| CAS-Nummer | |
| IUPHAR/BPS | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| ECHA-Infokarte |
100.029.983 |
| Chemische und physikalische Daten | |
| Formel | C 284 H 432 N 84 O 79 S 7 |
| Molmasse | 6 511 0,51 g · mol -1 |
|
| |
Das Medikament Aprotinin (Trasylol, ehemals Bayer und jetzt Nordic Group Pharmaceuticals ) ist ein kleinproteinhaltiger Rinderpankreastrypsin-Inhibitor ( BPTI ) oder ein basischer Trypsin-Inhibitor der Rinderpankreas , ein antifibrinolytisches Molekül, das Trypsin und verwandte proteolytische Enzyme hemmt . Unter dem Handelsnamen Trasylol wurde Aprotinin als benutztes Medikament durch verabreichte Injektion zu reduzieren Blutungen bei komplexen Operationen , wie Herz- und Leberchirurgie. Seine Hauptwirkung ist die Verlangsamung der Fibrinolyse , des Prozesses, der zum Abbau von Blutgerinnseln führt. Ziel der Anwendung war es, den Bedarf an Bluttransfusionen während der Operation sowie Endorganschäden durch Hypotonie (niedriger Blutdruck) als Folge eines starken Blutverlustes zu verringern. Das Medikament wurde 2007 weltweit vorübergehend vom Markt genommen, nachdem Studien darauf hindeuteten, dass seine Verwendung das Risiko von Komplikationen oder Tod erhöht; Dies wurde durch Folgestudien bestätigt. Der Verkauf von Trasylol wurde im Mai 2008 eingestellt, mit Ausnahme von sehr eingeschränkten Forschungszwecken. Im Februar 2012 kehrte der wissenschaftliche Ausschuss der Europäischen Arzneimittel-Agentur (EMA) seinen früheren Standpunkt zu Aprotinin zurück und empfahl, die Aussetzung aufzuheben. Nordic wurde 2012 zum Distributor von Aprotinin.
Chemie
| Rinderpankreastrypsin-Inhibitor | |||||||
|---|---|---|---|---|---|---|---|
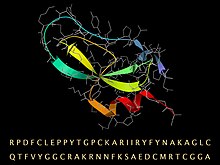 BPTI-Sequenz mit ihrer gefalteten 3D-Struktur, dargestellt durch ein Band für die Sekundärstruktur und ein Stabmodell (grau) für das Rückgrat und die Seitenketten.
| |||||||
| Identifikatoren | |||||||
| Organismus | |||||||
| Symbol | PTI | ||||||
| Entrez | 404172 | ||||||
| PDB | 4PTI Mehr Strukturen | ||||||
| RefSeq (mRNA) | NM_001001554 | ||||||
| RefSeq (Schutz) | NP_001001554 | ||||||
| UniProt | P00974 | ||||||
| Andere Daten | |||||||
| Chromosom | 13: 75,02 - 75,03 MB | ||||||
| |||||||
Aprotinin ist ein monomeres (einkettiges) globuläres Polypeptid, das aus Rinderlungengewebe gewonnen wird. Es hat ein Molekulargewicht von 6512 und besteht aus 16 verschiedenen Aminosäuretypen, die in einer 58 Reste langen Kette angeordnet sind, die sich zu einer stabilen, kompakten Tertiärstruktur des "kleinen SS-reichen" Typs faltet, die 3 Disulfide enthält, eine verdrehte β-Haarnadel und eine C-terminale α-Helix .
Die Aminosäuresequenz für Rinder-BPTI ist RPDFC LEPPY TGPCK ARIIR YFYNA KAGLC QTFVY GGCRA KRNNF KSAED CMRTC GGA. Es gibt 10 positiv geladene Lysin (K) und Arginin (R) Seitenketten und nur 4 negative Aspartat (D) und Glutamate (E), was das Protein stark basisch macht , was das basische in seinem Namen erklärt. (Aufgrund des üblichen Ausgangsorganismus wird BPTI manchmal als Rinderpankreastrypsin- Inhibitor bezeichnet.)
Die hohe Stabilität des Moleküls ist auf die 3 Disulfidbrücken zurückzuführen, die die 6 Cysteinglieder der Kette (Cys5-Cys55, Cys14-Cys38 und Cys30-Cys51) verbinden. Die lange, basische Lysin- 15-Seitenkette an der exponierten Schleife (im Bild oben links) bindet sehr fest in die Spezifitätstasche am aktiven Zentrum von Trypsin und hemmt dessen enzymatische Wirkung. BPTI wird als längere Vorläufersequenz synthetisiert, die sich zusammenfaltet und dann in die oben angegebene reife Sequenz gespalten wird.
BPTI ist das klassische Mitglied der Proteinfamilie der Serinprotease-Inhibitoren vom Kunitz-Typ . Zu seinen physiologischen Funktionen gehört die protektive Hemmung des wichtigsten Verdauungsenzyms Trypsin, wenn kleine Mengen produziert werden, durch Spaltung des Trypsinogen-Vorläufers während der Lagerung in der Bauchspeicheldrüse.
Mechanismus der Arzneimittelwirkung
Aprotinin ist ein kompetitiver Inhibitor mehrerer Serinproteasen , insbesondere Trypsin , Chymotrypsin und Plasmin in einer Konzentration von etwa 125.000 IE/ml und Kallikrein bei 300.000 IE/ml. Seine Wirkung auf Kallikrein führt zur Hemmung der Bildung von Faktor XIIa . Dadurch werden sowohl der intrinsische Gerinnungsweg als auch die Fibrinolyse gehemmt. Seine Wirkung auf Plasmin verlangsamt unabhängig die Fibrinolyse.
Arzneimittelwirksamkeit
Bei Herzoperationen mit einem hohen Risiko für einen signifikanten Blutverlust reduzierte Aprotinin signifikant Blutungen, Mortalität und Krankenhausaufenthalte. Positive Effekte wurden auch bei orthopädischen Hochrisikooperationen berichtet. Bei Lebertransplantationen wurden die ersten Berichte über den Nutzen von Bedenken hinsichtlich der Toxizität überschattet.
In einer 2004 durchgeführten Metaanalyse ging der Transfusionsbedarf bei koronaren Bypass- Operationen (CABG) um 39 % zurück . In der orthopädischen Chirurgie wurde ebenfalls eine Abnahme der Bluttransfusionen bestätigt.
Drogensicherheit
Es gab Bedenken hinsichtlich der Sicherheit von Aprotinin. Anaphylaxie (eine schwere allergische Reaktion) tritt bei der erstmaligen Anwendung mit einer Rate von 1:200 auf, aber Serologie (Messung von Antikörpern gegen Aprotinin im Blut) wird in der Praxis nicht durchgeführt, um das Anaphylaxierisiko vorherzusagen, da die korrekte Interpretation dieser Tests tests schwer.
Thrombosen , vermutlich aufgrund einer überaktiven Hemmung des fibrinolytischen Systems, können häufiger auftreten, aber bis 2006 gab es nur begrenzte Beweise für diesen Zusammenhang. Auch wenn bekannt war, dass sich biochemische Messungen der Nierenfunktion gelegentlich verschlechtern, gab es keine Hinweise darauf, dass dies die Ergebnisse stark beeinflusst. Eine 2006 an herzchirurgischen Patienten durchgeführte Studie zeigte, dass tatsächlich ein Risiko für akutes Nierenversagen , Myokardinfarkt und Herzinsuffizienz sowie Schlaganfall und Enzephalopathie besteht . Die Studienautoren empfehlen ältere Antifibrinolytika (wie Tranexamsäure ), bei denen diese Risiken nicht dokumentiert wurden. Dieselbe Gruppe aktualisierte ihre Daten im Jahr 2007 und zeigte ähnliche Ergebnisse.
Im September 2006 wurde der Bayer AG von der FDA vorgeworfen, dass sie während der Zeugenaussage nicht die Existenz einer in Auftrag gegebenen retrospektiven Studie mit 67.000 Patienten offenbart hatte, von denen 30.000 Aprotinin und der Rest andere Antifibrinolytika erhielten. Die Studie kam zu dem Schluss, dass Aprotinin größere Risiken birgt. Die FDA wurde von einem der beteiligten Forscher auf die Studie aufmerksam gemacht. Obwohl die FDA eine Erklärung zur Besorgnis herausgab, änderte sie ihre Empfehlung nicht, dass das Medikament bestimmten Teilpopulationen von Patienten zugute kommen könnte. In einem Public Health Advisory Update vom 3. Oktober 2006 empfahl die FDA, dass "Ärzte erwägen, die Anwendung von Trasylol auf solche Situationen zu beschränken, in denen der klinische Nutzen eines reduzierten Blutverlusts für die medizinische Behandlung notwendig ist und die potenziellen Risiken überwiegt" und Patienten sorgfältig zu überwachen.
Am 25. Oktober 2007 veröffentlichte die FDA eine Erklärung zur randomisierten Studie "Blutkonservierung mit Antifibrinolytika" (BART) in einer Population von Herzchirurgen. Die vorläufigen Ergebnisse legen nahe, dass Aprotinin im Vergleich zu anderen Antifibrinolytika (Epsilon-Aminocapronsäure und Tranexamsäure) das Sterberisiko erhöhen kann. Am 29. Oktober 2006 gab die Food and Drug Administration eine Warnung heraus, dass Aprotinin ernsthafte Nieren- und Herz-Kreislauf-Toxizität haben könnte. Der Hersteller, Bayer, berichtete der FDA, dass zusätzliche Beobachtungsstudien zeigten, dass es das Risiko für Tod, schwere Nierenschäden, kongestive Herzinsuffizienz und Schlaganfälle erhöhen kann. Die FDA warnte Ärzte davor, die Anwendung auf Situationen zu beschränken, in denen der klinische Nutzen eines reduzierten Blutverlusts für die medizinische Behandlung von wesentlicher Bedeutung ist und die potenziellen Risiken überwiegt. Am 5. November 2007 gab Bayer bekannt, dass Aprotinin aufgrund einer kanadischen Studie eingestellt wird, die gezeigt hat, dass es das Sterberisiko erhöht, wenn es zur Vorbeugung von Blutungen während einer Herzoperation eingesetzt wird.
Zwei Anfang 2008 veröffentlichte Studien, die beide Aprotinin mit Aminocapronsäure verglichen, ergaben , dass die Sterblichkeit um 32 bzw. 64 % erhöht war. Eine Studie ergab ein erhöhtes Risiko für die Notwendigkeit einer Dialyse und Revaskularisierung.
Es wurden keine Fälle einer Übertragung der bovinen spongiformen Enzephalopathie durch Aprotinin gemeldet, obwohl das Medikament in Italien aus Angst davor zurückgezogen wurde.
In-vitro-Anwendung
Kleine Mengen Aprotinin können Röhrchen mit entnommenem Blut zugesetzt werden, um Labormessungen von bestimmten schnell abgebauten Proteinen wie Glucagon zu ermöglichen .
In der Zellbiologie ist als Aprotinin verwendet Enzym - Inhibitor zu verhindern Proteinabbau während der Lyse oder Homogenisieren von Zellen und Geweben.
Aprotinin kann mit Fluoresceinisothiocyanat markiert werden. Das Konjugat behält seine antiproteolytischen und kohlenhydratbindenden Eigenschaften und wurde als fluoreszierendes histochemisches Reagenz zur Färbung von uron- oder sialinsäurereichen Glykokonjugaten (Schleimstoffen) verwendet.
Geschichte
Ursprünglich als "Kallikrein-Inaktivator" bezeichnet, wurde Aprotinin erstmals 1930 aus der Ohrspeicheldrüse von Rindern isoliert. 1936 unabhängig als Trypsin-Inhibitor aus der Rinderpankreas. Es wurde 1964 aus der Rinderlunge gereinigt. Da es Pankreasenzyme hemmt, wurde es zunächst in die Behandlung der akuten Pankreatitis , bei der die Zerstörung der Drüse durch ihre eigenen Enzyme als Teil der Pathogenese angesehen wird. Sein Einsatz in der großen Chirurgie begann in den 1960er Jahren.
BPTI ist eines der am gründlichsten untersuchten Proteine in Bezug auf Strukturbiologie , experimentelle und computergestützte Dynamik, Mutagenese und Faltungsweg . Es war eine der frühesten Proteinkristallstrukturen, die 1970 im Labor von Robert Huber gelöst wurde , und sein substratartiger Wechselwirkungsmodus wurde 1974 im Zusammenhang mit dem bovinen Trypsinkomplex entschlüsselt. Später wurde es auch als das erste Protein berühmt, das seine Struktur durch NMR-Spektroskopie bestimmt , Anfang der 1980er Jahre im Labor von Kurt Wuthrich an der ETH in Zürich.
Da es sich um ein kleines, stabiles Protein handelt, dessen Struktur bis 1975 mit hoher Auflösung bestimmt wurde, war es das erste Makromolekül von wissenschaftlichem Interesse, das 1977 von J. Andrew McCammon und Bruce Gelin in der Karplus- Gruppe mit Hilfe von Molekulardynamikberechnungen simuliert wurde in Harvard. Diese Studie bestätigte die damals überraschende Tatsache, die in der NMR-Arbeit gefunden wurde, dass selbst gut gepackte aromatische Seitenketten im Inneren eines stabilen Proteins ziemlich schnell umkippen können (Zeitskala von Mikrosekunden bis Millisekunden). Die Geschwindigkeitskonstanten wurden durch NMR für den Wasserstoffaustausch einzelner Peptid-NH-Gruppen entlang der Kette bestimmt und reichten von zu schnell, um auf der am stärksten exponierten Oberfläche gemessen zu werden, bis zu vielen Monaten für die am stärksten vergrabenen wasserstoffverbrückten Gruppen im Zentrum des β-Faltblatts, und diese Werte korrelieren auch ziemlich gut mit dem Bewegungsgrad, der in den Dynamiksimulationen beobachtet wird.
BPTI war wichtig für die Entwicklung des Wissens über den Prozess der Proteinfaltung , der Selbstorganisation einer Polypeptidkette zu einer bestimmten Anordnung in 3D. Das Problem, die richtigen Paarungen zwischen den 6 Cys-Seitenketten zu erreichen, erwies sich als besonders schwierig für die beiden vergrabenen, nahe beieinander liegenden SS in der Nähe der BPTI-Kettenenden, die ein nicht-natives Zwischenprodukt für die Faltung der reifen Sequenz in vitro erfordern (es war später entdeckten, dass sich die Vorläufersequenz in vivo leichter faltet ). BPTI war das Titelbild eines Kompendiums zur Proteinfaltung von Thomas Creighton aus dem Jahr 1992.
Aktuelle Erkenntnisse
Eine wissenschaftliche Studie an Ratten berichtete, dass die Behandlung mit Aprotinin eine Störung der Blut-Hirn-Schranke während der C. neoformans- Infektion verhindert. Eine weitere Studie in Zellkulturen legt nahe, dass das Medikament die SARS-CoV-2-Replikation hemmt.
