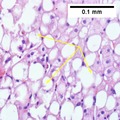
Nicht alkoholische Fettleber - Non-alcoholic fatty liver disease
| Nicht alkoholische Fettleber | |
|---|---|
| Andere Namen | NAFLD, metabolische (Dysfunktion) assoziierte Fettlebererkrankung, MAFLD |
 | |
| Stadien der nicht-alkoholischen Fettlebererkrankung, die von gesund zu Steatose (Fettansammlung), Entzündung, Fibrose und Zirrhose fortschreiten. | |
| Spezialität | Hepatologie |
| Symptome | Asymptomatisch , Leberfunktionsstörung |
| Komplikationen | Zirrhose , Leberkrebs , Leberversagen , Herz-Kreislauf-Erkrankungen |
| Dauer | Langfristig |
| Typen | Nichtalkoholische Fettleber (NAFL), nichtalkoholische Steatohepatitis (NASH) |
| Ursachen | Genetisch, Umwelt |
| Risikofaktoren | Fettleibigkeit , metabolisches Syndrom , Diabetes mellitus Typ 2 , Lebererkrankungen |
| Diagnosemethode | Leber Biopsie |
| Behandlung | Gewichtsverlust (Diät und Sport) |
| Prognose | Abhängig vom Typ |
| Frequenz | 24% der Weltbevölkerung, 80% der Adipositas, 20% der Normalgewichtigen |
| Todesfälle | NASH: 2,6% Sterberisiko pro Jahr |
Die nichtalkoholische Fettlebererkrankung ( NAFLD ), auch bekannt als metabolische (dysfunktions)assoziierte Fettlebererkrankung ( MAFLD ), ist eine übermäßige Fettansammlung in der Leber ohne eine andere eindeutige Ursache wie Alkoholkonsum . Es gibt zwei Arten; nichtalkoholische Fettleber ( NAFL ) und nichtalkoholische Steatohepatitis ( NASH ), wobei letztere auch Leberentzündungen einschließen . Eine nichtalkoholische Fettlebererkrankung ist weniger gefährlich als NASH und schreitet in der Regel nicht zu NASH oder Leberzirrhose fort . Wenn NAFLD zu NASH fortschreitet, kann dies schließlich zu Komplikationen wie Leberzirrhose, Leberkrebs , Leberversagen oder Herz-Kreislauf-Erkrankungen führen .
Fettleibigkeit und Typ-2-Diabetes sind starke Risikofaktoren für NAFLD. Weitere Risiken sind Übergewicht , metabolisches Syndrom (definiert als mindestens drei der fünf folgenden Erkrankungen: abdominale Fettleibigkeit, Bluthochdruck , hoher Blutzucker , hohe Serumtriglyzeride und niedriges HDL-Cholesterin im Serum ), eine fruktosereiche Ernährung und älteres Alter. NAFLD und alkoholische Lebererkrankung sind Formen der Fettleber . Die Entnahme einer Leberprobe nach Ausschluss anderer möglicher Ursachen einer Fettleber kann die Diagnose bestätigen.
Die Behandlung von NAFLD besteht in einer Gewichtsabnahme durch Ernährungsumstellung und Bewegung. Es gibt vorläufige Beweise für Pioglitazon und Vitamin E ; Eine bariatrische Operation kann schwere Fälle verbessern oder auflösen. Menschen mit NASH haben ein um 2,6% erhöhtes Sterberisiko pro Jahr.
NAFLD ist die weltweit häufigste Lebererkrankung und kommt bei etwa 25 % der Weltbevölkerung vor. Es ist auch in entwickelten Ländern wie den Vereinigten Staaten sehr verbreitet und betraf 2017 etwa 75 bis 100 Millionen Amerikaner. Über 90 % der fettleibigen, 60 % der Diabetiker und bis zu 20 % der Normalgewichtigen entwickeln es. NAFLD ist die häufigste Ursache für chronische Lebererkrankungen und der zweithäufigste Grund für Lebertransplantationen in den USA und Europa (Stand 2017). Etwa 20 bis 25 % der Menschen in Europa sind von NAFLD betroffen. Schätzungen zufolge haben in den Vereinigten Staaten zwischen 30 und 40 % der Erwachsenen NAFLD und etwa 3 bis 12 % der Erwachsenen NASH. Die jährliche wirtschaftliche Belastung in den USA betrug im Jahr 2016 rund 103 Milliarden US-Dollar.
Definition
Eine abnormale Ansammlung von Fett in der Leber in der Abwesenheit von sekundären Ursachen von Fettleber, wie signifikanter Alkoholkonsum , viraler Hepatitis , oder Medikamenten , die Fettleber induzieren kann charakterisiert nicht-alkoholische Fettleber (NASH). Der Begriff NAFLD umfasst ein Kontinuum von Leberanomalien, von der nichtalkoholischen Fettleber (NAFL, simple steatosis) bis zur nichtalkoholischen Steatohepatitis (NASH). Diese Erkrankungen beginnen mit einer Fettansammlung in der Leber ( Lebersteatose ). Eine Leber kann Fett bleiben ohne Leberfunktion (Nafl) zu stören, aber durch verschiedene Mechanismen und mögliche Beleidigungen in die Leber, kann es auch in nicht-alkoholische Steatohepatitis (NASH) fortschreiten, ein Zustand , in dem Steatose mit kombinierter Entzündung und manchmal Fibrose ( Steatohepatitis). NASH kann dann zu Komplikationen wie Leberzirrhose und hepatozellulärem Karzinom führen .
Ein neuer Name, metabolische Dysfunktion-assoziierte Fettlebererkrankung, wurde vorgeschlagen, nachdem 70 % eines Expertengremiums sich für diesen Namen ausgesprochen hatten.
Anzeichen und Symptome
Menschen mit NAFLD haben oft keine auffälligen Symptome , und NAFLD wird oft nur bei routinemäßigen Blutuntersuchungen oder einer nicht damit zusammenhängenden Bildgebung des Abdomens oder einer Leberbiopsie festgestellt . In einigen Fällen kann NAFLD Symptome im Zusammenhang mit Leberfunktionsstörungen wie Müdigkeit, Unwohlsein und dumpfen Bauchbeschwerden im rechten oberen Quadranten verursachen . Es kann zu einer leichten Gelbfärbung der Haut kommen, die jedoch selten vorkommt. NASH kann die Leberfunktion stark beeinträchtigen und zu Leberzirrhose , Leberversagen und Leberkrebs führen .
Komorbiditäten
NAFLD ist stark mit Typ-2-Diabetes, Insulinresistenz und metabolischem Syndrom (definiert als mindestens drei der fünf folgenden Erkrankungen) verbunden oder wird durch diese verursacht: abdominale Fettleibigkeit, Bluthochdruck, hoher Blutzucker, hohe Serumtriglyceride und niedrige Serumspiegel -Dichte Lipoprotein). Es ist auch mit hormonellen Störungen ( Panhypopituitarismus , Hypothyreose , Hypogonadismus , polyzystisches Ovarialsyndrom ), anhaltend erhöhten Transaminasen , zunehmendem Alter und Hypoxie durch obstruktive Schlafapnoe verbunden , wobei einige dieser Zustände das Fortschreiten der Krankheit vorhersagen.
Die Mehrheit der normalgewichtigen Menschen, die von NAFLD ("magere NAFLD") betroffen sind, haben eine eingeschränkte Insulinsensitivität, sind bewegungsarm und haben ein erhöhtes Risiko für Herz-Kreislauf-Erkrankungen und erhöhte Leberlipidspiegel. Dies sind die Folgen einer verminderten Fettspeicherkapazität und einer verminderten mitochondrialen Funktion im Fettgewebe und einer erhöhten hepatischen De-novo- Lipogenese . Eine kürzlich durchgeführte systematische Überprüfung hat ein erhöhtes Risiko einer schweren COVID-19-Infektion bei NAFLD-Patienten gemeldet; es wurde jedoch kein Unterschied in der Mortalität zwischen NAFLD- und Nicht-NAFLD-Patienten beobachtet.
Risikofaktoren
Genetik
Zwei Drittel der Familien mit Diabetes Typ 2 in der Vorgeschichte berichten von mehr als einem Familienmitglied mit NAFLD. Bei Familienmitgliedern, bei denen NASH diagnostiziert wurde, besteht ein höheres Fibroserisiko. Asiatische Bevölkerungen sind anfälliger für das metabolische Syndrom und NAFLD als ihre westlichen Gegenstücke. Hispanische Personen haben eine höhere Prävalenz von NAFLD als weiße Personen, während die niedrigste Prävalenz bei schwarzen Personen beobachtet wird. NAFLD kommt bei Männern doppelt so häufig vor wie bei Frauen, was durch einen niedrigeren Östrogenspiegel bei Männern erklärt werden könnte.
Genetische Variationen in zwei Genen sind mit NAFLD verbunden: nicht-synonyme Single-Nukleotid-Polymorphismen (SNPs) in PNPLA3 und TM6SF2 . Beide korrelieren mit dem Vorhandensein und der Schwere von NAFLD, ihre Rolle für die Diagnose bleibt jedoch unklar. Obwohl NAFLD eine genetische Komponente hat, empfiehlt die American Association for the Study of Liver Diseases (AASLD) kein Screening von Familienmitgliedern, da die Erblichkeit nicht ausreichend bestätigt ist, obwohl es einige Hinweise aus familiären Aggregations- und Zwillingsstudien gibt .
Diät
Laut der Asia-Pacific Working Group (APWG) zu NAFLD ist Überernährung ein wesentlicher Faktor von NAFLD und NASH, insbesondere bei schlanker NAFLD. Zusammensetzung und Menge der Nahrung , insbesondere Omega-6-Fettsäure und Fructose , spielen eine wichtige Rolle bei der Krankheitsprogression von NAFL zu NASH und Fibrose. Cholinmangel kann zur Entwicklung von NAFLD führen.
Lebensstil
Gewohnheitsmäßiges Schnarchen kann ein Risikofaktor für NAFLD sein, selbst nach Berücksichtigung etablierter Risikofaktoren bei Einzelpersonen. Schwere Fälle von Schnarchen führen zu Atemwegsblockaden oder Atembeschwerden beim Schlafen und signalisieren normalerweise das Vorliegen einer obstruktiven Schlafapnoe (OSAS), einer viel schwerwiegenderen Atemerkrankung. Eine Blockade oder Verengung der Atemwege, auch vorübergehend, kann dazu führen, dass der Körper einen niedrigeren Sauerstoffgehalt im Blut erfährt, und diese Zustände der Hypoxie treten bei Patienten mit obstruktiver Schlafapnoe (OSAS) wieder auf. Eine ständige Hypoxie kann eine Vielzahl von Veränderungen im Körper verursachen, wie z. B. Gewebeentzündung, erhöhte Insulinresistenz und Leberschäden. Eine prospektive Kohortenstudie ergab, dass der Zusammenhang zwischen gewohnheitsmäßigem Schnarchen und der Entwicklung von NAFLD signifikant ist, und es wurde festgestellt, dass der Trend bei schlanken Personen am deutlichsten war.
Pathophysiologie
Das Hauptmerkmal von NAFLD ist die Ansammlung von Lipiden in der Leber, hauptsächlich in Form von Triglyceriden . Die Mechanismen, durch die sich Triglyceride akkumulieren, und die Gründe, warum die Akkumulation zu Leberfunktionsstörungen führen kann, sind jedoch komplex und unvollständig verstanden. NAFLD kann Steatose zusammen mit verschiedenen Anzeichen einer Leberschädigung umfassen: entweder lobuläre oder portale Entzündung (eine Form der Leberschädigung) oder ballonierende Degeneration . In ähnlicher Weise können NASH histologische Eigenschaften wie Portal Entzündung, umfassen polymorphkerniger Zellen infiltriert, Mallory - Körper , apoptotischen Körper, klare Vakuolen Kerne, mikrovesikulären Steatose , megamitochondria und perisinusoidale Fibrose . NASH erhöht den Hepatozytentod durch Apoptose oder Nekroptose ist bei NASH im Vergleich zu einfacher Steatose erhöht, und Entzündungen sind ein Kennzeichen von NASH.
Ein umstrittener Mechanismus schlägt vor, dass sich die Lebersteatose nach einer weiteren Verletzung oder einem zweiten Treffer zu einer Steatose mit Entzündung entwickelt . Oxidativer Stress , hormonelle Ungleichgewichte und mitochondriale Anomalien sind mögliche Ursachen für dieses "Second Hit"-Phänomen. Ein weiteres Nutrigenomics- Modell namens Multiple Hit erweitert das zweite Hit- Modell, was darauf hindeutet, dass mehrere Krankheitsbiomarker und Faktoren wie Gene und Ernährung das Fortschreiten von NAFLD und NASH beeinflussen. Dieses Modell versucht, diese Faktoren zu verwenden, um die Auswirkungen von Änderungen des Lebensstils und der Genetik auf die Evolution der NAFLD-Pathologie vorherzusagen. Viele Forscher beschreiben NAFLD als Multisystemerkrankung , da sie andere Organe und Regulationswege als die Leber beeinflusst und beeinflusst wird.
Bei Personen mit NAFLD wird eine Akkumulation von seneszenten Zellen in der Leber beobachtet. Bei Mäusen führen seneszente Hepatozyten der Leber zu einer erhöhten Ablagerung von Leberfett. Es wurde gezeigt, dass die Behandlung von NAFLD-Mäusen mit senolytischen Mitteln die Lebersteatose reduziert.
Basierend auf Gen-Knockout- Studien in Mausmodellen wurde vorgeschlagen, dass neben vielen anderen pathogenen Faktoren TGF-beta-Signale entscheidend an der Förderung des Fortschreitens von NASH beteiligt sein könnten.
Fructosekonsum
Nichtalkoholische und alkoholische Fettlebererkrankungen weisen ähnliche histologische Merkmale auf, was darauf hindeutet, dass sie gemeinsame pathogene Pfade haben könnten. Fruktose kann ähnlich wie Ethanol eine Leberentzündung und -sucht verursachen, indem sie im Gegensatz zu Glukose ähnliche Stoffwechselwege nutzt. Daher argumentieren einige Forscher, dass sich nichtalkoholische und alkoholische Fettlebererkrankungen ähnlicher sind als bisher angenommen. Darüber hinaus fördert ein hoher Fructosekonsum die Fettansammlung in der Leber, indem er die De-novo- Lipogenese in der Leber stimuliert und die Beta-Oxidation von Fett reduziert . Im Gegensatz zum Zucker Glucose verstoffwechselt das Enzym Fructokinase Fructose schnell. Dies führt zu einem verringerten intrazellulären Adenosintriphosphat (ATP). Die Abnahme von ATP erhöht oxidativen Stress und Beeinträchtigungen der richtigen Proteinsynthese und der mitochondrialen Funktion in der Leber.
Insulinresistenz
Die Insulinresistenz trägt auf verschiedene Weise zur Ansammlung von giftigem Fett in der Leber bei. Erstens fördert es die Freisetzung von freien Fettsäuren (FFAs) aus dem Fettgewebe in das Blut. Typischerweise speichert Fettgewebe Lipide in Form von Triglyceriden , die bei niedrigem Insulinspiegel langsam in den Blutkreislauf abgegeben werden. In insulinresistentem Fettgewebe, wie bei Menschen mit Fettleibigkeit und Typ-2-Diabetes, werden mehr Triglyceride in FFAs abgebaut und in den Blutkreislauf freigesetzt, wodurch die Aufnahme durch die Leber gefördert wird. Zweitens fördert Insulin die Produktion neuer FFAs in der Leber über die De-novo- Lipogenese ; Diese Produktion von Leberfetten wird weiterhin durch Insulin stimuliert, selbst wenn andere Gewebe insulinresistent sind. Diese FFAs werden in der Leber wieder zu Triglyceriden kombiniert und bilden den Hauptbestandteil des angesammelten Fetts in der Leber. Zu den drei Quellen freier Fettsäuren, die zur Ansammlung von Triglyceriden in der Leber beitragen, gehören im Blutkreislauf zirkulierende FFAs (59%), aus Kohlenhydraten wie Fruktose und Glukose gewonnene FFAs (26%) und die Ernährung (14%). Trotz der Ansammlung von Triglyceriden in der Leber sind sie für das Lebergewebe nicht direkt toxisch. Stattdessen spielen Veränderungen des Profils der anderen in der Leber vorhandenen Lipid-Subtypen, wie Diacylglycerine , Phospholipide , Ceramide und freies Cholesterin , eine bedeutendere Rolle bei der Pathogenese von NAFLD.
Sobald die NAFLD bis zur NASH fortschreitet, fördert dies eine weitere Insulinresistenz im Fettgewebe und in der Leber, was zu einem schädlichen Zyklus aus Insulinresistenz, Leberfettansammlung und Entzündungen führt. Eine Funktionsstörung des Fettgewebes verringert auch die Sekretion des insulinsensibilisierenden Adipokins Adiponektin bei Menschen mit NAFLD. Adiponektin hat mehrere Eigenschaften, die die Leber schützen. Zu diesen Eigenschaften gehören ein verbesserter Leberfettstoffwechsel, eine verminderte De-novo- Lipogenese, eine verminderte Glukoseproduktion in der Leber , entzündungshemmende Eigenschaften und antifibrotische Eigenschaften. Auch die Insulinresistenz der Skelettmuskulatur kann bei NAFLD eine Rolle spielen. Insulinresistente Skelettmuskulatur ist bei der Aufnahme von Glukose aus dem Blut nach einer Mahlzeit nicht so effizient. Diese ineffiziente Glukoseaufnahme fördert die Umverteilung der aufgenommenen Kohlenhydrate von Glukose, die für die Verwendung in Glykogenspeichern in der Skelettmuskulatur bestimmt ist, um als Substrat für die De-novo- Lipogenese in der Leber verwendet zu werden.
Dysbiose
Störungen der Darmmikrobiota scheinen das NAFLD-Risiko auf verschiedene Weise zu beeinflussen. Menschen mit NASH können erhöhte Blut-Ethanol- und Proteobakterien (die Alkohol produzieren) haben, wobei Dysbiose als Mechanismus für diese Erhöhung vorgeschlagen wird. Veränderungen in der Zusammensetzung der Darmmikrobiota können das NAFLD-Risiko auf verschiedene Weise beeinflussen. Diese Veränderungen scheinen die Durchlässigkeit des Darmgewebes zu erhöhen, wodurch eine erhöhte Belastung der Leber mit schädlichen Substanzen (z. B. translozierte Bakterien, bakterielle Toxine und entzündliche chemische Signale ) begünstigt wird . Der verstärkte Transport dieser Schadstoffe in die Leber fördert Leberentzündungen, verbessert die Nährstoff- und Kalorienaufnahme und verändert den Cholinstoffwechsel . Höhere Mengen an Darmbakterien, die Butyrat produzieren, können schützend wirken.
Eine übermäßige Aufnahme von Makronährstoffen trägt zu Darmentzündungen und Störungen der Homöostase bei, und Mikronährstoffe können ebenfalls beteiligt sein. Neben der Reduzierung von Gewicht und Risikofaktoren können Änderungen des Lebensstils positive Veränderungen der Darmmikrobiota bewirken. Insbesondere die Ernährungsvielfalt kann eine Rolle spielen, die in Tierversuchen übersehen wurde, da sie oft eine westliche fettreiche Ernährung mit geringer Diversität mit einem fettarmen, aber vielfältigeren Futter vergleichen . Die gesundheitlichen Vorteile nach einer bariatrischen Operation können auch Veränderungen der Darmmikrobiota durch eine Erhöhung der Darmpermeabilität beinhalten.
Diagnose
NAFLD ist definiert durch den Nachweis einer Fettleber ohne einen weiteren Faktor, der die Leberfettansammlung erklären könnte, wie übermäßiger Alkoholkonsum (>21 Standardgetränke /Woche für Männer und >14 für Frauen in den USA; >30 g täglich für Männer und > 20 g für Frauen in Großbritannien und der EU, >140 g/Woche für Männer und >70 g/Woche für Frauen im asiatisch-pazifischen Raum und in den meisten klinischen Studien der NIH ), arzneimittelinduzierte Steatose , chronische Hepatitis C, Vererbung oder durch Mangel an parenteraler Gabe Ernährung wie Cholin und endokrine Erkrankungen. Wenn einer dieser Faktoren beobachtet wird, wird eine Untersuchung alternativer Ursachen der Fettleber ohne Bezug zu NAFLD empfohlen. Eine Vorgeschichte von chronischem Alkoholkonsum ist ein wichtiger Aspekt.
NAFLD umfasst zwei histologische Kategorien: NAFL und die aggressivere Form NASH. Das Vorhandensein von mindestens 5 % Fettleber ist sowohl bei NAFL als auch bei NASH üblich, aber die Merkmale einer erheblichen lobulären Entzündung und Hepatozytenverletzungen wie Ballonbildung oder Mallory-Hyaline treten nur bei NASH auf. Die Mehrheit der NAFL-Fälle zeigt eine minimale oder keine Entzündung. Perizentrale und perisinusoidale Fibrose treten häufiger bei NASH im Erwachsenenalter auf, während bei Kindern mit der Erkrankung eine portale Fibrose häufiger vorkommt. NASH stellt ein fortgeschritteneres Stadium der NAFL dar und ist mit schlechten Ergebnissen wie kardiovaskulären Ereignissen, Zirrhose oder hepatozellulärem Karzinom verbunden. ICD-11 verwendet den Begriff NAFL nicht, da er mit der Familie der Erkrankungen NAFLD verwechselt wurde. Die bevorzugten Beschreibungen sind stattdessen: NAFLD ohne NASH oder einfache Steatose und "NASH". Auch der Modifikator mit oder ohne Fibrose oder Zirrhose vervollständigt die diagnostische Beschreibung.
Bluttests
Erhöhte Leberenzyme sind häufig. Nach den Richtlinien des National Institute for Health and Care Excellence (NICE) wird davon abgeraten, Enzymspiegel zu testen, um NAFLD auszuschließen, da sie selbst bei fortgeschrittener Erkrankung oft im Normbereich liegen.
Blutuntersuchungen, die aus anderen , um zu bestätigen Diagnose oder Regel nützlich sind , schließen Blutsenkungsgeschwindigkeit , Glucose , Albumin und Nierenfunktion . Da die Leber für die Herstellung von Proteinen für die Blutgerinnung wichtig ist , werden häufig gerinnungsbezogene Studien durchgeführt, insbesondere die INR ( International Normalized Ratio ). Bei Menschen mit Fettleber mit begleitender entzündlicher Schädigung (Steatohepatitis) werden Bluttests in der Regel durchgeführt, um eine Virushepatitis (Hepatitis A, B, C und Herpesviren wie Epstein-Barr-Virus oder Cytomegalovirus ), Röteln und Autoimmunerkrankungen auszuschließen. Bei Menschen mit NASH tritt eine niedrige Schilddrüsenaktivität häufiger auf, die durch die Bestimmung des Schilddrüsen-stimulierenden Hormons festgestellt werden würde . Einige Biomarker-basierte Bluttests wurden entwickelt und können für die Diagnose nützlich sein.
Obwohl Bluttests NAFLD nicht diagnostizieren können, können zirkulierende Serumbiomarker für Leberfibrose moderate Schätzungen bei der Diagnose von Leberfibrose und -zirrhose liefern. Das Verhältnis des Transaminase- Leberenzyms Aspartat-Aminotransferase (AST) zu den Blutplättchen im Blut, bekannt als AST/Thrombozyten-Ratio-Index (APRI-Score), und Fibrotest werden von der Asian-Pacific Association for Study als bevorzugte nichtinvasive Tests für Zirrhose empfohlen der Leber (APASL). Mehrere andere Scores wie der FIB-4-Score und der NAFLD-Fibrose-Score können ebenfalls die Belastung der Leber durch die Fibrose widerspiegeln, und frühere Studien haben bestätigt, dass diese Scores die zukünftige Entwicklung von Mortalität und Leberkrebs vorhersagen können.
Bildgebung

Eine Leberultraschallscan oder Magnetresonanztomographie (MRI) kann Steatose diagnostizieren, aber nicht Fibrose und Zirrhose Bestätigung der frühen Erfassung durch Ultraschall von anderen Diagnoseverfahren empfohlen. Die European Association for the Study of the Liver (EASL) empfiehlt bei Verdacht auf NAFLD ein Screening auf Steatose, da dies ein starker Prädiktor für die Krankheitsentwicklung ist und zukünftige Typ-2-Diabetes, kardiovaskuläre Ereignisse und Bluthochdruck vorhersagt . Diese nicht-invasiven Methoden können für das NAFLD-Screening verwendet werden, werden jedoch in klinischen NAFLD- oder NASH-Studien nicht als Ersatz für eine Leberbiopsie akzeptiert, da nur eine Leberbiopsie die Leberpathologie definieren kann.
CT-Scans und MRTs sind bei der Erkennung einer Zirrhose genauer als herkömmlicher Ultraschall. Die transiente Elastographie wird für die anfängliche Beurteilung von Leberfibrose und -zirrhose empfohlen und hilft, Komplikationen und Prognose vorherzusagen, aber die Interpretation der Ergebnisse wird in Anbetracht limitierender Faktoren wie Steatose, hoher BMI, niedrigere Leberfibrose und enge Zwischenräume zwischen den Rippen (Interkostalräume). Die transiente Elastographie kann jedoch bei Menschen mit prähepatischer portaler Hypertonie versagen . Die transiente Elastographie wird nicht als Ersatz für eine Leberbiopsie angesehen.
Die Magnetresonanz-Elastographie (MRE) ist eine neue Methode, die die Leberfibrose genau beurteilen kann und wird von der APASL empfohlen. MRE besitzt eine gute Sensitivität zur Quantifizierung von Leberfett und eine ausgezeichnete Genauigkeit bei der Erkennung von Fibrose bei NAFLD unabhängig von BMI und Entzündung und wird als zuverlässigere Alternative zur Diagnose von NAFLD und ihrer Progression zu NASH im Vergleich zu Ultraschall- und Bluttests vorgeschlagen.
Leber Biopsie
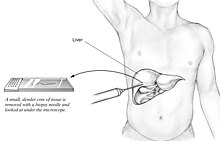

Eine Leberbiopsie (Gewebeuntersuchung) ist der einzige weit verbreitete Test (Goldstandard), um NAFLD (einschließlich NAFL und NASH) definitiv zu diagnostizieren und von anderen Formen von Lebererkrankungen zu unterscheiden und kann verwendet werden, um den Schweregrad der Entzündung und der daraus resultierenden Fibrose zu beurteilen. Da die meisten von NAFLD betroffenen Personen jedoch wahrscheinlich asymptomatisch sind, stellt eine Leberbiopsie ein zu hohes Risiko für die Routinediagnostik dar, sodass andere Methoden wie Lebersonographie oder Leber- MRT bevorzugt werden . Für junge Menschen empfehlen die Leitlinien eine Lebersonographie, aber die Biopsie bleibt der beste Beweis. Die Leberbiopsie ist auch der Goldstandard, um eine Leberfibrose zu erkennen und ihr Fortschreiten zu beurteilen. Routinemäßige Leberfunktions-Bluttests sind nicht empfindlich genug, um NAFLD zu erkennen, und die Biopsie ist das einzige Verfahren, das NAFL zuverlässig von NASH unterscheiden kann.
Zur Gewinnung von Lebergewebe stehen verschiedene Leberbiopsietechniken zur Verfügung. Die perkutane Leberbiopsie ist nach wie vor die gängigste Praxis. Biopsien können auch transvenös durchgeführt werden, entweder während einer Operation oder per Laparoskopie , insbesondere bei Personen mit Kontraindikationen für einen perkutanen Zugang. Die Leberbiopsie kann auch bildgesteuert erfolgen, in Echtzeit oder nicht, was für einige klinische Situationen empfohlen wird, z Schlagzeug, übergewichtige Menschen und Menschen mit offensichtlichem Aszites. Die Vitalfunktionen müssen danach häufig kontrolliert werden (mindestens alle 15 Minuten in der Stunde nach der Biopsie).
Gemäß den AASLD-Richtlinien kann eine Leberbiopsie bei Personen mit NAFLD in Betracht gezogen werden, die ein erhöhtes Risiko für eine Steatohepatitis mit oder ohne fortgeschrittener Fibrose haben, jedoch nur, wenn alle anderen konkurrierenden chronischen Lebererkrankungen (wie z. B. alkoholische Lebererkrankungen) ausgeschlossen werden. Das Vorhandensein eines metabolischen Syndroms, des NAFLD-Fibrose-Scores (FIB-4) oder der Lebersteifigkeit (gemessen durch vibrationskontrollierte transiente Elastographie oder MRE ) können die Personen identifizieren, die ein höheres Risiko für Steatohepatitis oder fortgeschrittene Fibrose haben.
Die AASLD und ICD-11 sind der Ansicht, dass klinisch nützliche Pathologieberichte "zwischen NAFL (Steatose), NAFL mit Entzündung und NASH (Steatose mit lobulärer und portaler Entzündung und hepatozellulärer Ballonbildung)" unterscheiden, wobei das Vorhandensein oder Fehlen von Fibrose beschrieben und optional kommentiert wird Schwere. Die EASL empfiehlt den Fatty Liver Inhibition of Progression (FLIP)-Algorithmus, um das Aufblähen zu bewerten und NAFLD-assoziierte Leberschäden zu klassifizieren, und die Verwendung des NAFLD-Aktivitäts-Scores (NAS), um den Schweregrad der NASH einzustufen, anstatt deren Diagnose zu stellen. Sie betrachten auch den Steatose-, Aktivitäts- und Fibrose-Score (SAF) als genaues und reproduzierbares Bewertungssystem. Die AASLD empfiehlt die Verwendung des NAS-Scoring-Systems mit oder ohne SAF-Score, wenn dies als angemessen erachtet wird. Die Asia-Pacific Working Group on NAFLD rät von der Verwendung von NAS ab, da es als nicht informativ für NAFLD und unangemessen für die Diagnose von NASH angesehen wird.
Zur Beurteilung der Leberfibrose ist eine perkutane Leberbiopsie mit oder ohne Bildführung bei unkooperativen Personen kontraindiziert. Die transjuguläre Leberbiopsie ist indiziert für alle Personen mit diffuser Lebererkrankung, die eine Biopsie benötigen, aber eine Kontraindikation für eine perkutane Biopsie haben oder zu diagnostischen Zwecken eine hämodynamische Untersuchung benötigen. Bei Patienten mit klinisch manifestem Aszites wird eine transvenöse Leberbiopsie anstelle eines perkutanen Zugangs empfohlen, obwohl die perkutane Biopsie ein akzeptabler alternativer Ansatz nach der Entfernung von Aszites ist.
Verwaltung
NAFLD rechtfertigt eine Behandlung unabhängig davon, ob die betroffene Person übergewichtig ist oder nicht. NAFLD ist eine vermeidbare Todesursache . Richtlinien sind erhältlich von der American Association for the Study of Liver Diseases (AASLD), der American Association of Clinical Endocrinologists (AACE), dem National Institute for Health and Care Excellence (NICE), der European Association for the Study of the Liver (EASL) und der Asien-Pazifik-Arbeitsgruppe zu NAFLD.
Lebensstil
Gewichtsverlust ist die wirksamste Behandlung von NAFLD. Ein Verlust von 4 bis 10 % des Körpergewichts wird empfohlen, wobei 10 bis 40 % Gewichtsverlust die NASH ohne Zirrhose vollständig aufheben. Ein strukturiertes Programm zur Gewichtsreduktion hilft Menschen mit NAFLD, mehr Gewicht zu verlieren als eine Beratung allein. Diese Art von Programm führt auch zu Verbesserungen der NAFLD, die mit Bluttests, Ultraschall, Bildgebung oder Leberbiopsien gemessen wird. Obwohl sich die Fibrose mit Lebensstilinterventionen und Gewichtsverlust verbessert, gibt es nur begrenzte Beweise für eine Verbesserung der Zirrhose.
Eine Kombination aus verbesserter Ernährung und Bewegung scheint am besten zu helfen, NAFLD zu kontrollieren und die Insulinresistenz zu reduzieren. Eine motivierende Unterstützung, etwa mit einer kognitiven Verhaltenstherapie , ist hilfreich, da die meisten Menschen mit NAFLD ihren Zustand nicht als Krankheit wahrnehmen und somit eine geringe Veränderungsmotivation haben.
Verhaltenstherapien zur Gewichtsabnahme mit höherer Intensität (Diät und Bewegung kombiniert) können zu mehr Gewichtsverlust führen als solche mit geringerer Intensität. Gewichtsverlust ist mit Verbesserungen der Biomarker, des NAFLD-Grades und einer verringerten Wahrscheinlichkeit von NASH verbunden, aber ihre Auswirkungen auf die langfristige Gesundheit sind noch unbekannt. Ein systematischer Review aus dem Jahr 2019 schlägt daher eine Änderung der Leitlinien vor, um diese Therapien für das NAFLD-Management zu empfehlen.
Diät
Die Behandlung von NAFLD beinhaltet typischerweise eine Beratung zur Verbesserung der Ernährung und der Kalorieneinschränkung . Menschen mit NAFLD können von einer moderaten bis kohlenhydratarmen Ernährung und einer fettarmen Ernährung profitieren. Auch die mediterrane Ernährung zeigte in einer 6-wöchigen Studie vielversprechende Ergebnisse mit einer Reduzierung von NASH-induzierten Entzündungen und Fibrose, unabhängig vom Gewichtsverlust. Vorläufige Beweise unterstützen diätetische Interventionen bei Personen mit Fettleber, die nicht übergewichtig sind.
Die EASL empfiehlt eine Energiebeschränkung von 500–1000 kcal pro Woche weniger als die normale tägliche Ernährung (eine sehr kalorienarme Diät ), ein Ziel von 7–10 % Gewichtsverlust bei fettleibiger/übergewichtiger NAFLD, einer fettarmen bis mäßig fettreichen , kohlenhydratarme bis kohlenhydratreiche Ernährung oder eine kohlenhydratarme ketogene oder proteinreiche Ernährung wie die Mittelmeerdiät und Vermeidung aller fructosehaltigen Getränke und Lebensmittel.
Alkohol ist ein erschwerender Faktor, und die AASLD empfiehlt Menschen mit NAFLD oder NASH, Alkoholkonsum zu vermeiden. Die EASL erlaubt einen Alkoholkonsum unter 30 g/Tag für Männer und 20 g/Tag für Frauen. Die Rolle des Kaffeekonsums für die NAFLD-Behandlung ist unklar, obwohl einige Studien darauf hindeuten, dass regelmäßiger Kaffeekonsum eine schützende Wirkung haben kann.
Vitamin E verbessert die etablierte Leberfibrose bei Patienten mit NAFLD nicht, scheint jedoch bestimmte Marker der Leberfunktion zu verbessern und bei einigen Menschen mit NAFLD Entzündungen und Fettigkeit der Leber zu reduzieren. Die Asia-Pacific Work Group weist darauf hin, dass Vitamin E den Leberzustand und den Aminotransferase-Spiegel verbessern kann, jedoch nur bei Erwachsenen ohne Diabetes oder Zirrhose, die an NASH leiden. Die NICE-Richtlinien empfehlen Vitamin E als Option für Kinder und Erwachsene mit NAFLD mit fortgeschrittener Leberfibrose, unabhängig davon, ob die Person an Diabetes mellitus leidet.
Pflanzliche Verbindungen wie Silymarin (ein Mariendistelsamenextrakt ), Curcumin, ein Kurkuma-Extrakt und grüner Tee scheinen die NAFLD-Biomarker zu verbessern und den NAFLD-Grad zu reduzieren. Studien legen einen Zusammenhang zwischen mikroskopisch kleinen Organismen, die den Darm bewohnen (Mikrobiota) und NAFLD nahe. Reviews berichteten, dass die Verwendung von Probiotika und Synbiotika (Kombinationen von Probiotika und Präbiotika ) mit einer Verbesserung der leberspezifischen Marker für Leberentzündungen, Messungen der Lebersteifigkeit und Steatose bei Personen mit NAFLD verbunden waren.
Physische Aktivität
Gewichtsverlust kann NAFLD verbessern und wird insbesondere für fettleibige oder übergewichtige Menschen empfohlen; ähnliche körperliche Aktivitäten und Diäten sind für übergewichtige Menschen mit NAFLD ratsam wie für andere adipöse und übergewichtige Menschen. Obwohl körperliche Aktivität für die Gewichtsabnahme weniger wichtig ist als diätetische Anpassungen (um die Kalorienaufnahme zu reduzieren), empfiehlt das NICE körperliche Aktivität, um das Leberfett zu reduzieren, auch wenn es keine allgemeine Körpergewichtsreduzierung gibt. Gewichtsverlust durch Bewegung oder Diät ist der effektivste Weg, um Leberfett zu reduzieren und die Remission von NASH und Fibrose zu unterstützen. Bewegung allein kann Lebersteatose verhindern oder reduzieren, aber es bleibt unbekannt, ob sie alle anderen Aspekte der Leber verbessern kann; daher wird ein kombinierter Ansatz mit Diät und Bewegung empfohlen. Aerobes Training kann effektiver sein als Widerstandstraining, obwohl es widersprüchliche Ergebnisse gibt. Kräftiges Training ist einem moderaten Training vorzuziehen, da nur das hochintensive Training die Wahrscheinlichkeit verringert, dass sich NAFLD zu NASH oder fortgeschrittener Fibrose entwickelt. Die EASL empfiehlt zwischen 150 und 200 min/Woche in 3 bis 5 Sitzungen moderater Intensität aerober körperlicher Aktivität oder Krafttraining. Da beide effektiv Leberfett reduzieren, wird ein pragmatischer Ansatz bei der Wahl der körperlichen Aktivität bevorzugt, der die Vorlieben des Einzelnen berücksichtigt, was er langfristig aufrechterhalten kann. Jegliches Engagement in körperlicher Aktivität oder eine Steigerung über das vorherige Niveau ist besser, als im Sitzen zu bleiben.
Medikation
Die Behandlung mit Medikamenten zielt in erster Linie darauf ab, Lebererkrankungen zu verbessern und ist im Allgemeinen auf Patienten mit biopsiebewiesener NASH und Fibrose beschränkt.
Keine Medikamente speziell für NAFLD oder NASH hatte erhielt die Genehmigung, wie 2018, obwohl antidiabetische Medikamente in der Leber Fettabbau helfen können. Während viele Behandlungen biochemische Marker wie die Alanin-Transaminase- Spiegel zu verbessern scheinen, können die meisten histologischen Anomalien nicht rückgängig machen oder die Ergebnisse verbessern.
Insulinsensibilisatoren ( Metformin und Thiazolidindione , wie Pioglitazon ) und Liraglutid werden bei NAFLD nicht speziell empfohlen, da sie den Leberzustand nicht direkt verbessern. Sie können bei Diabetikern nach sorgfältiger Risikoabwägung indiziert sein, um die Insulinresistenz und das Risiko von Komplikationen zu reduzieren. Tatsächlich haben die mit Thiazolidindion-Medikamenten verbundenen Nebenwirkungen, zu denen Osteopenie , erhöhtes Frakturrisiko, Flüssigkeitsretention, kongestive Herzinsuffizienz , Blasenkrebs und langfristige Gewichtszunahme gehören, ihre Akzeptanz eingeschränkt. Aufgrund dieser Nebenwirkungen empfiehlt die AASLD die Verwendung von Pioglitazon nur für Personen mit biopsiegeprüfter NASH und die Asia-Pacific Work Group empfiehlt sie nur für Personen mit NAFLD mit bekannten diabetischen Problemen. Die AASLD rät jedoch von der Anwendung von Metformin ab, da Studien über die Verbesserung des histologischen Zustands der Leber nicht eindeutig waren. Obwohl es eine Verbesserung der Insulinresistenz und der Serum-Aminotransferasen gab, führte dies nicht zu einer Verbesserung der NASH. Das NICE stellt bezüglich Pioglitazon ähnliche Leitlinien wie die AASLD bereit und empfiehlt Erwachsenen mit fortgeschrittener Leberfibrose, es in der Sekundärversorgung zu verabreichen, unabhängig davon, ob sie an Diabetes leiden oder nicht.
Statin- Medikamente scheinen die Leberhistologie und Marker der Leberbiochemie bei Menschen mit NAFLD zu verbessern. Da Menschen mit NAFLD ein höheres Risiko für Herz-Kreislauf-Erkrankungen haben, ist eine Behandlung mit Statinen angezeigt. Menschen mit NAFLD haben laut AASLD und EASL kein höheres Risiko für schwere Leberschäden durch Statine. Auch wenn Statine bei Menschen mit NASH-Zirrhose sicher anzuwenden sind, schlägt die AASLD vor, sie bei Menschen mit dekompensierter Zirrhose zu vermeiden. Leitlinien empfehlen Statine zur Behandlung von Dyslipidämie für Menschen mit NAFLD. Gemäß den NICE-Richtlinien können Statine fortgesetzt werden, es sei denn, die Leberenzymwerte verdoppeln sich innerhalb von drei Monaten nach Beginn der Statine. Eine Behandlung mit Pentoxifyllin wird nicht empfohlen.
Ab 2018 empfehlen weder die AASLD noch die Asia-Pacific Working Group Obeticholsäure oder Elafibranor aufgrund inkonsistenter Ergebnisse für die NASH-Behandlung und Bedenken hinsichtlich der Sicherheit.
Omega-3-Fettsäuren können das Leberfett reduzieren und das Blutfettprofil verbessern, scheinen jedoch die Leberhistologie nicht zu verbessern (Fibrose, Zirrhose, Krebs). Das NICE empfiehlt keine Nahrungsergänzung mit Omega-3-Fettsäuren, da randomisierte Studien nicht schlüssig waren. Frühere systematische Übersichtsarbeiten ergaben, dass eine Omega-3-Fettsäure-Supplementierung bei Patienten mit NAFLD/NASH mit Dosen von einem Gramm täglich oder mehr (mediane Dosis vier Gramm/Tag bei einer medianen Behandlungsdauer von sechs Monaten) mit einer Verbesserung des Leberfetts verbunden war. Gemäß den AASLD-Richtlinien sollten „Omega-3-Fettsäuren nicht als spezifische Behandlung von NAFLD oder NASH verwendet werden, aber sie können zur Behandlung von Hypertriglyzeridämie bei Patienten mit NAFLD in Betracht gezogen werden“.
Operation

Die bariatrische Chirurgie ist eine wirksame Methode für adipöse und diabetische Personen mit NAFLD, um eine Gewichtsabnahme zu induzieren und eine NASH-Entzündung, einschließlich Fibrose, zu reduzieren oder zu lösen und die Langlebigkeit zu verbessern. Bei der AASLD kann eine bariatrische Operation nur bei NASH im Einzelfall durch ein erfahrenes bariatrisches Chirurgieprogramm in Betracht gezogen werden. In der Tat können einige Personen neue oder verschlechterte Merkmale von NAFLD entwickeln.
Ungefähr 92 % der Menschen mit NAFLD sahen eine Verbesserung der Steatose und 70 % eine vollständige Rückbildung nach einer bariatrischen Operation.
Eine präoperative Diät wie eine kalorienarme Diät oder eine sehr kalorienarme Diät wird in der Regel empfohlen, um das Lebervolumen um 16–20 % zu reduzieren. Der präoperative Gewichtsverlust ist der einzige Faktor, der mit dem postoperativen Gewichtsverlust verbunden ist. Eine präoperative Gewichtsabnahme kann die Operationszeit und den Krankenhausaufenthalt verkürzen, obwohl es keine ausreichenden Beweise dafür gibt, ob eine präoperative Gewichtsabnahme die langfristige Morbidität oder Komplikationen reduziert. Gewichtsverlust und Abnahme der Lebergröße können unabhängig von der Kalorieneinschränkung sein.
Die APWG on NAFLD empfiehlt bariatrische Chirurgie als Behandlungsoption für Menschen mit Adipositas der Klasse II ( BMI >32,5 kg/m 2 für Asiaten, 35 kg/m 2 für Kaukasier). Sie halten seine Auswirkungen auf die Verbesserung leberbedingter Komplikationen für noch nicht bewiesen, aber es erhöht effektiv die Lebensdauer durch die Verbesserung kardiovaskulärer Faktoren.
Eine Operation birgt ein höheres Risiko für Personen mit NASH-Zirrhose, wobei eine Überprüfung die Gesamtmorbidität auf 21% schätzt. Für Menschen mit NAFLD, die eine undifferenzierte Zirrhose haben, empfiehlt die APWG eine Untersuchung, um die Ursache der Zirrhose sowie die Leberfunktion der Person zu ermitteln und ob sie eine portale Hypertonie haben.
Screening
Das Screening des Herz-Kreislauf-Systems wird von der EASL als obligatorisch angesehen, da NAFLD-Ergebnisse oft zu kardiovaskulären Komplikationen führen , die sich als subklinische Atherosklerose äußern können , die die Mehrheit der NAFLD-bedingten Todesfälle verursacht. Menschen mit NAFLD haben ein hohes Risiko für kardiovaskuläre Morbidität und Mortalität, und laut AASLD ist „eine aggressive Modifikation der Risikofaktoren für kardiovaskuläre Erkrankungen bei allen Patienten mit NAFLD gerechtfertigt“.
Darüber hinaus empfiehlt die AASLD bei Patienten mit einer zirrhotischen NASH ein systematisches Screening auf Magen- und Ösophagusvarizen sowie auf Leberkrebs . Sie empfehlen keine routinemäßigen Leberbiopsien und kein Screening auf Leberkrebs bei nicht zirrhotischen Menschen mit NASH, aber ein solches Screening findet manchmal von Fall zu Fall statt.
Menschen mit NAFLD können auch für ein Screening auf hepatozelluläres Karzinom (Leberkrebs) und gastroösophageale Varizen in Betracht gezogen werden . Das NICE empfiehlt Erwachsenen alle drei Jahre und Kindern alle zwei Jahre ein regelmäßiges Screening auf NAFLD auf fortgeschrittene Leberfibrose, bei dem der Bluttest zur verbesserten Leberfibrose (ELF) verwendet wird. Follow-up wird für Menschen mit Fettleibigkeit und Insulinresistenz unter Verwendung des Homöostase-Modells zur Bewertung der Insulinresistenz (HOMA-IR) empfohlen . Menschen mit NASH mit Fibrose und Bluthochdruck verdienen eine genauere Überwachung, da ein höheres Risiko für das Fortschreiten der Krankheit besteht.
Transplantation
NAFLD ist seit 2017 die zweithäufigste Indikation für Lebertransplantationen in den USA und Europa. NAFLD/NASH wird voraussichtlich bis 2020 die führende Ursache für Lebertransplantationen werden.
Für Menschen mit NASH und Lebererkrankungen im Endstadium, Leberversagen oder Leberkrebs ist eine Lebertransplantation gemäß der EASL ein akzeptiertes Verfahren. Menschen mit NASH-Zirrhose NASH, die für eine Lebertransplantation in Betracht gezogen werden, erfordern eine systematische Untersuchung auf Herz-Kreislauf-Erkrankungen (ob die Symptome offensichtlich sind oder nicht).
Das Gesamtüberleben ist vergleichbar mit einer Transplantation nach anderen Erkrankungen. Menschen mit NASH-Zirrhose, die sich einer Lebertransplantation unterziehen, sterben eher nach der Transplantation an einer Herz-Kreislauf-Erkrankung oder einer chronischen Nierenerkrankung . Diese Menschen mit NASH sind oft älter und daher anfälliger für diese Komplikationen. Aus diesen und anderen Gründen können Personen mit morbider Adipositas ( BMI ≥ 40 kg/m 2 ) und NASH mit Zirrhose als ungeeignet für eine Lebertransplantation angesehen werden, bis sie eine Änderung des Lebensstils zur Reduzierung des Körpergewichts vornehmen. Diabetiker mit schlechter Blutzuckerkontrolle sind ähnlichen Risiken ausgesetzt, und eine optimale Blutzuckerkontrolle ist vor einer Transplantation unerlässlich.
Die Leitlinien der Asia Pacific Working Group empfehlen Gesundheitsdienstleistern, vor und nach der Transplantation Lebensstiländerungen zu diskutieren, um potenzielle Operationsrisiken zu reduzieren und das NAFLD-Management nach der Transplantation zu unterstützen.
In Ausnahmefällen wurden gleichzeitig bariatrische Operationen und Lebertransplantationen durchgeführt.
Nach der Transplantation ist die Leberbiopsie die beste Methode, um die Entwicklung der Posttransplantationsfibrose zu überwachen, wobei eine signifikante Fibrose oder portale Hypertonie ein Jahr nach der Transplantation ein schnelles Fortschreiten und einen Transplantatverlust vorhersagt und die Notwendigkeit einer dringenden Intervention anzeigt.
Verwandte Komplikationen
Es gibt keine spezielle Behandlung für Leberkrebs im Zusammenhang mit NAFLD/NASH und wird gemäß den allgemeinen Leitlinien für Leberkrebs behandelt.
Prognose
Die durchschnittliche Progressionsrate von einem Stadium der Leberfibrose zum nächsten bei Menschen mit NASH wird auf sieben Jahre geschätzt, verglichen mit 14 Jahren mit NAFLD. Der Verlauf der Progression variiert mit unterschiedlichen klinischen Manifestationen bei den einzelnen Personen. Die Fibrose bei Menschen mit NASH schritt schneller voran als bei Menschen mit NAFLD. Adipositas prognostiziert ein schlechteres Langzeitergebnis als bei schlanken Personen. Im asiatisch-pazifischen Raum entwickeln etwa 25 % der NAFLD-Fälle unter drei Jahren eine NASH, aber nur ein geringer Anteil (3,7 %) entwickelt eine fortgeschrittene Leberfibrose. Eine internationale Studie zeigte, dass Menschen mit NAFLD eine 10-Jahres-Überlebensrate von 81,5 % hatten.
NAFLD ist ein Risikofaktor für Fibrose, Bluthochdruck, chronische Nierenerkrankung, Vorhofflimmern , Myokardinfarkt, ischämischen Schlaganfall und Tod durch kardiovaskuläre Ursachen, basierend auf Evidenz von sehr niedriger bis niedriger Qualität aus Beobachtungsstudien. Obwohl NAFLD Zirrhose und Leberversagen sowie Leberkrebs verursachen kann, sind die meisten Todesfälle bei Menschen mit NAFLD auf Herz-Kreislauf-Erkrankungen zurückzuführen. Laut einer Metaanalyse von 34.000 Menschen mit NAFLD über sieben Jahre hinweg haben diese Personen ein um 65 % erhöhtes Risiko, tödliche oder nicht tödliche kardiovaskuläre Ereignisse zu entwickeln, im Vergleich zu Personen ohne NAFLD.
NAFLD und NASH erhöhen das Leberkrebsrisiko. Leberzirrhose und durch NAFLD induzierter Leberkrebs waren 2017 die zweite Ursache für Lebertransplantationen in den USA. Leberkrebs entwickelt sich bei NASH ohne Zirrhose in 45% der Fälle, und Menschen mit NASH-Zirrhose haben ein erhöhtes Risiko für Leberkrebs. Die mit NASH assoziierte Leberkrebsrate hat sich zwischen 2002 und 2012 in den USA vervierfacht, was mehr ist als bei jeder anderen Ursache von Leberkrebs. NAFLD ist der dritthäufigste Risikofaktor für Leberkrebs. NAFLD und NASH verschlimmerten sich mit Zirrhose bei 2–3% bzw. 15–20% der Menschen über einen Zeitraum von 10–20 Jahren. Zirrhose wird nur bei etwa 50% der Menschen mit NAFLD und mit Leberkrebs gefunden, so dass Leberkrebs und Zirrhose nicht immer miteinander verbunden sind.
NAFLD kann ein Vorläufer des metabolischen Syndroms sein, obwohl eine bidirektionale Beeinflussung möglich ist. Das Vorliegen und das Stadium einer Fibrose sind die stärksten prognostischen Faktoren für leberbedingte Ereignisse und Mortalität, insbesondere für NAFLD.
Epidemiologie
Die Inzidenz von NAFLD nimmt zusammen mit Fettleibigkeit und Diabetes rapide zu und ist in den Industrieländern bei Erwachsenen, Jugendlichen und Kindern die häufigste Ursache für Lebererkrankungen. Der Anteil der Menschen mit NAFLD liegt in verschiedenen Teilen der Welt zwischen 9 und 36,9 %. Ungefähr 20 % der US-amerikanischen und 25 % der asiatisch-pazifischen Bevölkerung haben eine nichtalkoholische Fettleber. Eine ähnliche Prävalenz ist in Europa zu finden, obwohl weniger Daten verfügbar sind. NAFLD ist im Nahen Osten (32 %) und Südamerika (30 %) am häufigsten, während Afrika die niedrigsten Raten (13 %) aufweist. Im Vergleich zu den 2000er Jahren stiegen NAFL und NASH in den USA in den 2010er Jahren um das 2-Fache bzw. das 2,5-Fache.
NAFLD und NASH sind bei Hispanics häufiger - was auf die hohen Raten von Fettleibigkeit und Typ-2-Diabetes bei hispanischen Bevölkerungsgruppen zurückzuführen ist, bei Weißen mittlerer und bei Schwarzen am niedrigsten. Es wurde beobachtet, dass NAFLD bei Männern doppelt so häufig vorkommt wie bei Frauen. Für stark übergewichtige Personen steigt die Prävalenz von NAFLD über 90%, und für diejenigen mit Diabetes , mehr als 60% und bis zu 20% für normalgewichtige Menschen. NAFLD tritt bei 65 bis 90 % der Patienten auf, die sich einer bariatrischen Operation unterzogen haben, und bis zu 75 % von ihnen haben NASH. Ultraschall- und Protonen-NMR-Spektroskopie-Studien deuten darauf hin, dass etwa 25% der Bevölkerung von NAFLD oder NASH betroffen zu sein scheinen.
Obwohl die Krankheit häufig mit Fettleibigkeit in Verbindung gebracht wird, ist ein erheblicher Anteil der Erkrankten normalgewichtig oder schlank. Von einer mageren NAFLD sind zwischen 10 und 20 % der Amerikaner und Europäer und etwa 25 % der Asiaten betroffen, obwohl einige Länder eine höhere Inzidenz aufweisen (z. B. hat Indien einen sehr hohen Anteil an magerer NAFLD und fast keine fettleibige NAFLD). PNPLA3 kann für das Fortschreiten der NAFLD bei schlanken Menschen relevant sein. Daher verdienen Menschen, die an NAFLD leiden, unabhängig vom Vorliegen oder Fehlen von Fettleibigkeit für eine Behandlung in Betracht gezogen.
Bei Kindern im Alter von 1 bis 19 Jahren lag die Prävalenz in Studien mit Daten aus Kliniken für Adipositas bei Kindern bei ca. 8 % in der Allgemeinbevölkerung bis 34 %.
Es wird angenommen, dass die Mehrheit der kryptogenen Zirrhose auf NASH zurückzuführen ist. Es wird erwartet, dass die NAFLD-Prävalenz stetig zunehmen wird, von 25 % im Jahr 2018 auf voraussichtlich 33,5 % der Menschen mit NAFLD weltweit im Jahr 2030, und von 20 % auf voraussichtlich 27 % der Menschen mit NAFLD werden zu NASH übergehen.
Geschichte
Der erste bekannte Fall von fettleibiger nicht-alkoholischer Fettleber wurde 1952 von Samuel Zelman beobachtet. Zelman begann mit den Ermittlungen, nachdem er eine Fettleber bei einem Krankenhausmitarbeiter beobachtet hatte, der täglich mehr als zwanzig Flaschen Coca-Cola trank. Dann entwarf er anderthalb Jahre lang eine Studie mit 20 fettleibigen Menschen, die nicht alkoholisiert waren, und stellte fest, dass etwa die Hälfte von ihnen eine beträchtliche Fettleber hatte. Fettleber wurde jedoch mindestens seit 1784 mit Diabetes in Verbindung gebracht – eine Beobachtung, die in den 1930er Jahren wieder aufgegriffen wurde. Studien an Versuchstieren deuteten in den 1920er Jahren auf Cholinmangel und 1949 auf übermäßigen Zuckerkonsum hin.
Der Name "nicht-alkoholische Steatohepatitis" (NASH) wurde später 1980 von Jürgen Ludwig und seinen Kollegen von der Mayo Clinic definiert , um auf die Existenz dieser Pathologie aufmerksam zu machen, da ähnliche Berichte zuvor als "Patientenlügen" abgetan wurden. Dieses Papier wurde zu dieser Zeit meist ignoriert, wurde aber schließlich als wegweisendes Papier angesehen, und ab Mitte der 1990er Jahre wurde der Zustand intensiv untersucht, wobei seit 1998 eine Reihe internationaler Treffen zu diesem Thema abgehalten wurden Der breitere NAFLD-Begriff wurde um 2002 herum verwendet. Diagnostische Kriterien wurden ausgearbeitet, und 2005 schlug das Pathology Committee des NIH NASH Clinical Research Network das NAS-Scoring-System vor.
Gesellschaft und Kultur
Politische Empfehlungen
Die EASL empfiehlt den europäischen Gesundheitsbehörden, „Werbung und Vermarktung von zuckergesüßten Getränken und industriell verarbeiteten Lebensmitteln mit hohem Gehalt an gesättigten Fettsäuren, Zucker und Salz einzuschränken“ sowie „steuerliche Maßnahmen zur Verhinderung des Konsums von zuckergesüßten Getränken und Rechtsvorschriften zu sicherzustellen, dass die Lebensmittelindustrie die Kennzeichnung und die Zusammensetzung verarbeiteter Lebensmittel verbessert" sowie "öffentliche Sensibilisierungskampagnen über Lebererkrankungen, in denen hervorgehoben wird, dass diese nicht nur mit übermäßigem Alkoholkonsum verbunden sind".
Lobbyarbeit
In Frankreich wurde das französische Syndikat für alkoholfreie Getränke "Boissons Rafraîchissantes de France" (das Hersteller von Erfrischungsgetränken wie Coca-Cola France, Orangina, PepsiCo France umfasste) von der französischen Zeitschrift fr:Canard Enchainé wegen Irreführung der Verbraucher mit a Kommunikation auf ihrer Website mit dem Titel "Die NASH-Pathologie besser verstehen", in der erklärt wird, dass "die NASH-Pathologie manchmal als Soda-Krankheit durch Sprachmissbrauch oder eine unglückliche semantische Abkürzung bezeichnet wird, da sie nicht direkt mit dem Konsum alkoholfreier Getränke in Verbindung steht". Diese Seite und andere auf derselben Website, wie beispielsweise eine mit dem Titel "Sag nein zu Desinformation", wurden seitdem entfernt.
Kinder
Die pädiatrische NAFLD wurde erstmals 1983 gemeldet. Sie ist die häufigste chronische Lebererkrankung bei Kindern und Jugendlichen seit mindestens 2007, von der 10 bis 20 % in den USA im Jahr 2016 betroffen waren. NAFLD ist mit dem metabolischen Syndrom verbunden , das eine Gruppe von Risikofaktoren, die zur Entwicklung von Herz-Kreislauf-Erkrankungen und Typ-2-Diabetes mellitus beitragen. Studien haben gezeigt, dass insbesondere abdominale Fettleibigkeit und Insulinresistenz einen wesentlichen Beitrag zur Entwicklung von NAFLD leisten. Koexistierende Lebererkrankungen wie Hepatitis C und Herz-Kreislauf-Erkrankungen wie Arteriosklerose sind ebenfalls mit einem erhöhten NAFLD-Risiko verbunden. Einige Kinder wurden bereits im Alter von zwei Jahren diagnostiziert, mit einem durchschnittlichen Diagnosealter zwischen 11 und 13 Jahren. Das Durchschnittsalter liegt in der Regel über 10 Jahren, da auch Kinder über unspezifische Symptome berichten können und somit eine NAFLD schwer zu diagnostizieren ist.
Jungen werden häufiger mit NAFLD diagnostiziert als Mädchen. Übergewicht oder sogar Gewichtszunahme im Kindes- und Jugendalter ist mit einem erhöhten NAFLD-Risiko im späteren Leben verbunden, wobei die NAFLD bei Erwachsenen in einer 31-Jahres-Follow-up-Studie anhand von Risikofaktoren im Kindesalter wie BMI, Plasmainsulinspiegel, männlich . vorhergesagt wurde Geschlecht, genetischer Hintergrund (PNPLA3- und TM6SF2-Varianten) und niedriges Geburtsgewicht, ein neuer Risikofaktor für NAFLD im Erwachsenenalter. In einer Studie lag bei Kindern mit klinischem Verdacht auf NAFLD bei bis zu 45 % eine einfache Steatose vor. Kinder mit einfacher Steatose haben eine schlechtere Prognose als Erwachsene, wobei signifikant mehr von ihnen von NAFLD zu NASH übergehen als Erwachsene. Tatsächlich entwickeln 17-25 % der Kinder mit NAFLD im Allgemeinen eine NASH und bis zu 83 % bei Kindern mit schwerer Adipositas (im Vergleich zu 29 % bei Erwachsenen), was weiter darauf hindeutet, dass die Leberfibrose bei Kindern einen aggressiveren klinischen Verlauf zu nehmen scheint als zu Erwachsenen.
Eine frühzeitige Diagnose von NAFLD bei Kindern kann dazu beitragen, die Entwicklung einer Lebererkrankung im Erwachsenenalter zu verhindern. Dies ist eine Herausforderung, da die meisten Kinder mit NAFLD asymptomatisch sind und nur 42-59% Bauchschmerzen zeigen. Andere Symptome können vorhanden sein, wie Schmerzen im rechten oberen Quadranten oder Acanthosis nigricans , von denen letztere häufig bei Kindern mit NASH auftritt. Eine vergrößerte Leber tritt bei 30–40% der Kinder mit NAFLD auf.
Die AASLD empfiehlt bei unklarer Diagnose oder vor Beginn einer potenziell hepatotoxischen medikamentösen Therapie eine diagnostische Leberbiopsie bei Kindern. Die EASL schlägt vor, Fibrosetests wie Elastographie , akustische Strahlungskraftimpulsbildgebung und Serum-Biomarker zu verwenden, um die Anzahl der Biopsien zu reduzieren. Im Anschluss empfehlen die NICE-Richtlinien, dass Gesundheitsdienstleister den Kindern alle zwei Jahre ein regelmäßiges NAFLD-Screening auf fortgeschrittene Leberfibrose mit dem Bluttest zur verbesserten Leberfibrose (ELF) anbieten. Mehrere Studien schlagen auch die Magnetresonanz-Elastographie als Alternative zur weniger zuverlässigen Sonographie vor.
Intensive Änderungen des Lebensstils, einschließlich körperlicher Aktivität und Ernährungsumstellung, sind die erste Behandlungslinie nach AASLD und EASL, da sie die Leberhistologie und die Aminotransferase-Spiegel verbessern. In Bezug auf die pharmakologische Behandlung empfehlen die AASLD und EASL kein Metformin, aber Vitamin E kann bei einigen Kindern die Lebergesundheit verbessern. Das NICE rät zur Einnahme von Vitamin E bei Kindern mit fortgeschrittener Leberfibrose, unabhängig davon, ob sie Diabetes haben oder nicht. Die einzige Behandlung, die sich bei NAFLD im Kindesalter als wirksam erwiesen hat, ist die Gewichtsabnahme.
Einige Hinweise deuten darauf hin, dass mütterliche Unter- oder Überernährung die Anfälligkeit eines Kindes für NASH erhöht und dessen Fortschreiten beschleunigt.
Forschung
Diagnose und Biomarker
Da eine NAFLD-Diagnose basierend auf einer Leberbiopsie invasiv ist und eine Einschätzung der Epidemiologie erschwert, ist es eine hohe Forschungspriorität, genaue, kostengünstige und nicht-invasive Methoden zur Diagnose und Überwachung der NAFLD-Erkrankung und ihres Fortschreitens zu finden. Die Suche nach diesen Biomarkern von NAFLD, NAFL und NASH umfasst Lipidomik , medizinische Bildgebung , Proteomik , Bluttests und Bewertungssysteme.
Laut einer Überprüfung kann die Schätzung der Protonendichte des Fettanteils durch Magnetresonanztomographie (MRT-PDFF) als der genaueste und sogar Goldstandardtest zur Quantifizierung von Lebersteatose angesehen werden. Sie empfehlen eine ultraschallbasierte transiente Elastographie, um sowohl Fibrose als auch Zirrhose in einer klinischen Routineumgebung mit größerer Objektivität als Ultraschall, aber mit geringerer Genauigkeit als Magnetresonanz-Elastographie genau zu diagnostizieren; und Plasma-Cytokeratin 18 (CK18)-Fragment-Spiegel, um ein mäßig genauer Biomarker für Steatohepatitis zu sein. Die transiente Elastographie kann jedoch bei Menschen mit prähepatischer portaler Hypertonie versagen.
Medikamentenentwicklung
Die Entwicklung von Medikamenten für NASH ist sehr aktiv und schreitet schnell voran. Es werden neue Medikamente entwickelt, die auf verschiedene intrahepatische Stellen abzielen, von der Regulierung der Lipide und der Glukosehomöostase bis hin zu oxidativem Stress und mitochondrialen Zielen in Hepatozyten, Entzündungssignalen auf Hepatozyten und intrazellulären Zielen im Zusammenhang mit der Aktivierung und Fibrogenese von hepatischen Sternzellen . Ab 2021 laufen zulassungsrelevante Studien für Obeticholsäure ( FXR- Agonist), Resmetirom ( THRβ- Agonist), Belapektin ( Galectin-3- Inhibitor) und Aramchol ( SCD1- Inhibitor).
Siehe auch
- Foie gras , bei Geflügel induzierte Fettleber, mit einer Pathophysiologie, die der von NAFLD beim Menschen homolog ist
Verweise
Externe Links
- NIH- Seite zu nichtalkoholischer Steatohepatitis
- Mayo Clinic Seite auf NAFLD
| Einstufung | |
|---|---|
| Externe Ressourcen |