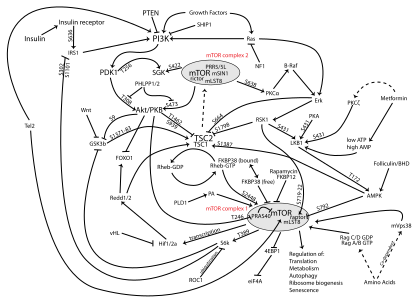
PI3K/AKT/mTOR-Pfad - PI3K/AKT/mTOR pathway
Der PI3K/AKT/mTOR-Signalweg ist ein intrazellulärer Signalweg, der für die Regulierung des Zellzyklus wichtig ist . Daher steht es in direktem Zusammenhang mit zellulärer Ruhe , Proliferation , Krebs und Langlebigkeit. Die PI3K- Aktivierung phosphoryliert und aktiviert AKT und lokalisiert es in der Plasmamembran . AKT kann eine Reihe von nachgeschalteten Wirkungen haben, wie die Aktivierung von CREB , die Hemmung von p27 , die Lokalisierung von FOXO im Zytoplasma, die Aktivierung von PtdIns -3ps und die Aktivierung von mTOR, was die Transkription von p70 oder 4EBP1 beeinflussen kann. Es gibt viele bekannte Faktoren, die den PI3K/AKT-Signalweg verbessern, einschließlich EGF , shh , IGF-1 , Insulin und CaM. Sowohl Leptin als auch Insulin rekrutieren PI3K-Signale für die Stoffwechselregulation. Der Weg wird durch verschiedene Faktoren, einschließlich PTEN , GSK3B und HB9, antagonisiert.
Bei vielen Krebsarten ist dieser Signalweg überaktiv, wodurch die Apoptose reduziert und die Proliferation ermöglicht wird. Dieser Weg ist jedoch notwendig, um das Wachstum und die Proliferation über die Differenzierung von adulten Stammzellen , insbesondere von neuralen Stammzellen , hinaus zu fördern . Es ist die Schwierigkeit, ein angemessenes Maß an Proliferation versus Differenzierung zu finden, das Forscher zu ermitteln versuchen, um dieses Gleichgewicht bei der Entwicklung verschiedener Therapien zu nutzen. Darüber hinaus hat sich herausgestellt, dass dieser Signalweg eine notwendige Komponente bei der neuronalen Langzeitpotenzierung ist .
Proliferation neuronaler Stammzellen
Reaktion auf Glukose
Neurale Stammzellen (NSCs) im Gehirn müssen ein Gleichgewicht zwischen der Aufrechterhaltung ihrer Multipotenz durch Selbsterneuerung und -proliferation im Gegensatz zu Differenzierung und Ruhe finden. Der PI3K/AKT-Pfad ist in diesem Entscheidungsprozess entscheidend. NSCs sind in der Lage, Veränderungen im Gehirn oder im gesamten Organismus wahrzunehmen und darauf zu reagieren. Bei einem akuten Anstieg des Blutzuckerspiegels wird Insulin aus der Bauchspeicheldrüse ausgeschüttet. Die Aktivierung von Insulinrezeptoren aktiviert den PI3K/AKT-Signalweg, der die Proliferation fördert. Auf diese Weise wird bei hohem Glukose- und Energieüberschuss im Organismus der PI3K/AKT-Weg aktiviert und NSCs neigen zur Proliferation. Bei geringen verfügbaren Energiemengen ist der PI3K/AKT-Weg weniger aktiv und die Zellen nehmen einen Ruhezustand ein. Dies geschieht teilweise, wenn AKT FOXO phosphoryliert und FOXO im Zytoplasma hält. FOXO kann, wenn es dephosphoryliert ist, in den Zellkern eindringen und als Transkriptionsfaktor wirken , um die Expression verschiedener Tumorsuppressoren wie p27 und p21 zu fördern . Diese Tumorsuppressoren bringen das NSC dazu, in Ruhe zu treten. FOXO-Knockouts verlieren die Fähigkeit von Zellen, in einen Ruhezustand einzutreten, sowie Zellen, die ihren neuralen Stammzellcharakter verlieren und möglicherweise in einen krebsähnlichen Zustand übergehen.
PTEN
Der PI3K/AKT-Signalweg enthält einen natürlichen Inhibitor namens PTEN, dessen Funktion es ist, die Proliferation in Zellen zu begrenzen und so zur Vorbeugung von Krebs beizutragen. Es hat sich gezeigt, dass das Ausschalten von PTEN die Gehirnmasse aufgrund der auftretenden unregulierten Proliferation erhöht. PTEN wirkt, indem es PIP3 zu PIP2 dephosphoryliert, was die Fähigkeit von AKT, an die Membran zu binden, einschränkt und seine Aktivität verringert. PTEN-Mängel können stromabwärts ausgeglichen werden, um Differenzierung oder Ruhe zu retten. Aus diesem Grund ist das Ausschalten von PTEN nicht so schwerwiegend wie das Ausschalten von FOXO.
CREB
Das cAMP-Response-Element CREB steht in engem Zusammenhang mit der Zellentscheidung, sich zu vermehren oder nicht. Zellen, die gezwungen sind, AKT zu überexprimieren, erhöhen die Menge an CREB und die Proliferation im Vergleich zu Wildtyp-Zellen. Diese Zellen exprimieren auch weniger gliale und neurale Zellmarker wie GFAP oder β-Tubulin . Dies liegt daran, dass CREB ein Transkriptionsfaktor ist, der die Transkription von Cyclin A beeinflusst, was die Proliferation fördert. Zum Beispiel müssen adulte neurale Vorläuferzellen des Hippocampus als Stammzellen ruhen, um sich später zu differenzieren. Dies wird von Shh geregelt . Shh funktioniert durch eine langsame Proteinsynthese-Abhängigkeit, die andere Kaskaden stimuliert, die synergistisch mit dem PI3K/AKT-Weg arbeiten, um die Proliferation zu induzieren. Dann kann der andere Weg abgeschaltet werden und die Wirkungen des PI3K/AKT-Wegs werden unzureichend, um die Differenzierung zu stoppen. Die Besonderheiten dieses Weges sind unbekannt.
Rollen bei Krebs
Bei Eierstockkrebs
Der PI3K / AKT / mTOR- Signalweg ist ein zentraler Regulator von Eierstockkrebs . PIM- Kinasen werden bei vielen Krebsarten überexprimiert und tragen auch zur Regulierung von Eierstockkrebs bei . PIM aktivieren direkt und indirekt mTOR und seine vorgeschalteten Effektoren wie AKT. Außerdem können PIM- Kinasen eine Phosphorylierung von IRS verursachen, die PI3K verändern kann . Dies weist auf das enge Zusammenspiel von PIM mit der PI3K / AKT / mTOR- Kaskade und ihren Komponenten hin. In ähnlicher Weise wurde auch berichtet, dass AKT die BAD-Phosphorylierung in OC-Zellen durchführt. PIM und das PI3K/AKT/mTOR-Netzwerk können beide die P21- und P27- Expression in OC-Zellen hemmen . Diese Daten deuten auf eine starke Interaktionsmöglichkeit und Relevanz von PIM-Kinasen und dem PI3K/AKT/mTOR-Netzwerk bei der Regulation von Eierstockkrebs hin. Die gezielte Ausrichtung dieses Signalwegs bei Eierstockkrebs war jedoch eine Herausforderung, da mehrere Studien keinen ausreichenden klinischen Nutzen erzielten.
Bei Brustkrebs
Bei vielen Arten von Brustkrebs sind Aberrationen im PI3K/AKT/mTOR-Signalweg die häufigsten genomischen Anomalien. Zu den häufigsten bekannten Aberrationen zählen die PIK3CA -Genmutation und die Loss-of-Function-Mutationen oder das epigenetische Silencing des Phosphatase- und Tensinhomologen (PTEN). Der Phosphoinositid-3-Kinase (PI3K)/Proteinkinase B (Akt)/Säuger-Target von Rapamycin (mTOR)-Signalweg wird in ca. 30–40 % der BC-Fälle aktiviert. Bei TNBC kann die onkogene Aktivierung des PI3K/AKT/mTOR-Signalwegs als Funktion der Überexpression von vorgeschalteten Regulatoren wie EGFR , aktivierenden Mutationen von PIK3CA , Funktionsverlust oder Expression von Phosphatase und Tensin-Homolog (PTEN) und dem prolinreichen . erfolgen Inositolpolyphosphatase, die PI3K herunterregulieren. Dies stimmt mit der Hypothese überein, dass PI3K-Inhibitoren die Resistenz gegen eine endokrine Therapie überwinden können, wenn sie erworben wird
Bei Urothelkrebs
PIK3CA weisen häufig Gain-of-Function-Mutationen bei Urothelkarzinomen auf. Ähnlich wie PI3Ka wird PI3Kb in vielen verschiedenen Zellen exprimiert und ist hauptsächlich an der Aktivierung von Blutplättchen und der Entwicklung thrombotischer Erkrankungen beteiligt. Studien haben gezeigt, dass auch PI3Kb zur Tumorproliferation beiträgt. Insbesondere spielt es eine wichtige Rolle bei der Tumorentstehung bei PTEN- negativen Krebsarten. Es wird berichtet, dass die Störung des Gens für PI3Kb ein therapeutischer Ansatz für Hochrisiko-Blasenkrebs mit mutiertem PTEN- und E-Cadherin- Verlust sein könnte. Spezifische Isoform-Inhibitoren von PI3Kb sind eine potenzielle Behandlung für PTEN-defiziente Krebsarten.
Bei Prostatakrebs
Der PI3K-Signalweg ist eine der Hauptursachen für Arzneimittelresistenzen bei Prostatakrebs . Dies gilt insbesondere für kastrationsresistenten Prostatakrebs, bei dem Tumore gegen eine Androgenentzugstherapie resistent werden , was die Fähigkeit des Tumors blockiert, das Hormon Androgen zum Wachstum zu nutzen . Dies ist auf einen komplexen Rückkopplungsmechanismus zurückzuführen, der zwischen dem Androgenrezeptor und dem PI3K-Weg besteht. Wie bei anderen Tumorarten können Mutationen in Schlüsselgenen dieses Signalwegs zu einer Hyperaktivierung dieses Signalwegs führen, beispielsweise bei PIK3CA. Erhöhungen der Kopienzahl von PIK3CA und eine erhöhte mRNA- Expression erhöhen unter anderem auch die Aktivierung des Signalwegs bei Prostatakrebs. Gewinne in der nahen genetischen Region 3q26.31-32 zu gezeigt wurde , zusammen auftreten mit einer Reihe von in der Nähe PI3K Familienmitglieder einschließlich PIK3CA , PIK3CB und PIK3R4 , was zu Transkriptions Veränderungen in PIK3C2G , PIK3CA, PIK3CB, PIK3R4 sowie Wegen assoziiert mit Zellvermehrung . Diese weitreichenden Gewinne sind mit dem Gleason-Grad , dem Tumorstadium , der Lymphknotenmetastasierung und anderen aggressiven klinischen Merkmalen verbunden. Bei Patienten, die mit PI3K-Inhibitoren behandelt wurden, scheinen Patienten mit einer Zunahme der Kopienzahl bei PIK3CB eine erhöhte Arzneimittelanfälligkeit zu haben.
Therapien
PI3K-Inhibitor
PI3K- Inhibitoren können Arzneimittelresistenzen überwinden und die Ergebnisse bei fortgeschrittenem Brustkrebs (ABC) verbessern. Unterschiedliche PI3K-Inhibitoren zeigen unterschiedliche Wirkung gegen verschiedene PI3K-Typen. Pan-PI3K-Inhibitoren der Klasse IA wurden ausführlicher untersucht als Isoform-spezifische Inhibitoren; Pictilisib ist ein weiterer pan-PI3K-Inhibitor mit einer stärkeren Aktivität als Subunitα-Inhibitor als Buparlisib. Idelalisib ist der erste von der US-amerikanischen Food and Drug Administration zugelassene PI3K-Inhibitor und wird zur Behandlung von rezidivierter/refraktärer chronischer lymphatischer Leukämie/kleinem lymphatischen Lymphom und follikulärem Lymphom eingesetzt. Copanlisib ist für rezidivierte follikuläre Lymphome bei Patienten zugelassen, die mindestens zwei vorherige systemische Therapien erhalten haben. Duvelisib ist für rezidivierende/refraktäre chronische lymphatische Leukämie /kleines lymphatisches Lymphom (CLL/SLL) und rezidiviertes/refraktäres follikuläres Lymphom zugelassen, beides Indikationen für Patienten, die mindestens zwei vorangegangene Therapien erhalten haben.
Akt-Inhibitor
AKT ist PI3K nachgelagert und wird durch Ipatasertib gehemmt. Akt ist eine Kinase der AGC-Familie und ein zentraler, integraler Signalknoten des PAM- Signalwegs. Es gibt drei Akt-Isozyme, Akt1, Akt2 und Akt3. Niedermolekulare Akt1-Inhibitoren könnten besonders nützlich sein, um Tumore mit einer hohen Prävalenz von Akt1-E17K-aktivierenden Mutationen zu bekämpfen, die bei 4–6% der Brustkrebsarten und 1–2% der Darmkrebserkrankungen beobachtet wird. Die Forschung zur Akt- Hemmung hat sich auf die Hemmung zweier unterschiedlicher Bindungsstellen konzentriert: (1) die allosterische Tasche des inaktiven Enzyms und (2) die ATP-Bindungsstelle. Allosterische Akt-Inhibitoren, hervorgehoben durch MK-2206, wurden in einer klinischen Umgebung umfassend evaluiert; Kürzlich wurden weitere allosterische Akt-Inhibitoren identifiziert. ARQ-092, ist ein potenter Pan-Akt-Inhibitor, der das Tumorwachstum präklinisch hemmen kann und befindet sich derzeit in klinischen Phase-I-Studien.
mTOR-Inhibitor
Es besteht eine signifikante Korrelation von phosphoryliertem mTOR mit der Überlebensrate von Patienten mit TNBC der Stadien I und II . Ein von Patienten abgeleitetes Xenograft-TNBC-Modell, das den mTOR-Inhibitor Rapamycin testete, zeigte eine Hemmung des Tumorwachstums von 77–99 %, was signifikant mehr ist als bei Doxorubicin; Studien zur Proteinphosphorylierung zeigten, dass die konstitutive Aktivierung des mTOR-Signalwegs mit der Behandlung abnahm.
Duale PI3K/AKT/mTOR-Inhibitoren
Es wurde die Hypothese aufgestellt, dass eine Blockade des PI3K/AKT/mTOR-Signalwegs zu einer erhöhten Antitumoraktivität bei TNBC führen kann . Präklinische Daten haben gezeigt, dass die Kombination von Verbindungen, die auf verschiedene verwandte Moleküle im PI3K/AKT/mTOR-Weg abzielen, zu einer synergistischen Aktivität führt. Basierend auf diesen Erkenntnissen werden weiterhin neue Wirkstoffe entwickelt, die gleichzeitig auf verschiedene Komponenten des PI3K/AKT/mTOR-Signalwegs abzielen. Zum Beispiel hemmt Gedatolisib mutierte Formen von PI3K-α mit erhöhter Kinaseaktivität bei Konzentrationen, die der IC50 für Wildtyp-PI3K-α äquivalent sind. Die PI3K-β-, -δ- und -γ-Isoformen wurden durch Gedatolisib in Konzentrationen gehemmt, die etwa 10-fach höher waren als die für PI3K-α beobachteten. Ein weiterer Vorteil des gleichzeitigen Targetings von PI3K und mTOR ist die daraus resultierende stärkere Hemmung der Rezeptor-Tyrosinkinase-positiven Rückkopplungsschleifen, die bei isolierter PI3K- Hemmung beobachtet wird. Gedatolisib wird derzeit zur Behandlung von TNBC in Kombination mit PTK7-Antikörper-Wirkstoff-Konjugat entwickelt. Apitolisib (GDC-0980) ist ein PI3K-Inhibitor (Untereinheiten α, δ und γ), der auch auf mTORC . abzielt
Co-gezielte Therapie des PI3K-Signalwegs
Es gibt zahlreiche Zellsignalwege, die ein Cross-Talk mit dem PI3K-Signalweg aufweisen, wodurch Krebszellen möglicherweise der Hemmung von PI3K entkommen können. Daher könnte die Hemmung des PI3K-Signalwegs zusammen mit anderen Zielen eine synergistische Reaktion bieten, wie sie bei der gleichzeitigen Hemmung von PI3K und MEK in Lungenkrebszellen beobachtet wird. In jüngerer Zeit wurde die gemeinsame Ausrichtung des PI3K-Signalwegs mit PIM-Kinasen vorgeschlagen, wobei zahlreiche präklinische Studien den potenziellen Nutzen dieses Ansatzes nahelegen. Die Entwicklung von Zelllinien, die gegen die Hemmung des PI3K-Signalwegs resistent sind, könnte zur Identifizierung zukünftiger Co-Targets führen und zu einem besseren Verständnis, welche Signalwege den Verlust des PI3K-Signalwegs nach einer medikamentösen Behandlung kompensieren können. Eine kombinierte PI3K-Hemmung mit traditionelleren Therapien wie einer Chemotherapie kann auch ein besseres Ansprechen gegenüber einer alleinigen PI3K-Hemmung bieten.
Neurale Stammzellen
Die Art der Signalübertragung durch Wachstumsfaktoren kann beeinflussen, ob sich NSCs in Motoneuronen differenzieren oder nicht. Das Vorbereiten eines Mediums mit FGF2 verringert die Aktivität des PI3K/AKT-Signalwegs, der GSK3β aktiviert. Dies erhöht die Expression von HB9. Die direkte Hemmung von PI3K in NSCs führt zu einer Population von Zellen, die rein HB9+ sind und sich mit erhöhter Effizienz in Motoneuronen differenzieren. Die Transplantation dieser Zellen in verschiedene Teile von Ratten erzeugt Motoneuronen, unabhängig von der Mikroumgebung der transplantierten Zellen. Nach einer Verletzung treten neurale Stammzellen in eine Reparaturphase ein und exprimieren hohe Mengen an PI3K, um die Proliferation zu verstärken. Dies ist besser für das Überleben der Neuronen als Ganzes, geht aber auf Kosten der Erzeugung von Motoneuronen. Daher kann es für verletzte Motoneuronen schwierig sein, ihre Fähigkeit wiederherzustellen. Ziel der modernen Forschung ist es, neurale Stammzellen zu erzeugen, die sich vermehren, aber dennoch zu Motoneuronen differenzieren können. Die Verringerung der Wirkung des PI3K-Signalwegs und die Erhöhung der Wirkung von GSK3β und HB9 in NSCs ist ein möglicher Weg, diese Zellen zu erzeugen.
PTEN-Hemmer
PTEN ist ein Tumorsuppressor, der den PI3K/AKT-Signalweg hemmt. PTEN-Inhibitoren wie Bisperoxovanadium können den PI3K/AKT-Signalweg verstärken, um die Zellmigration, das Überleben und die Proliferation zu fördern. Während es einige Bedenken hinsichtlich einer möglichen Dysregulation des Zellzyklus und einer Tumorentstehung gibt, kann eine vorübergehende und moderate PTEN-Hemmung eine Neuroprotektion gegen traumatische Hirnverletzungen bewirken und die Erholung des ZNS verbessern, indem verlorene Verbindungen durch Axonogenese wiederhergestellt werden . Der medizinische Wert von PTEN-Inhibitoren muss noch bestimmt werden.
Langzeitpotenzierung
Damit eine Langzeitpotenzierung (LTP) erfolgen kann, müssen NMDA-Rezeptoren stimuliert werden , was dazu führt, dass AMPA-Rezeptoren postsynaptisch eingefügt werden . PI3K bindet an AMPA-Rezeptoren in einer konservierten Region, um die Rezeptoren in der Membran auszurichten, insbesondere an der GluR-Untereinheit. Die PI3K-Aktivität nimmt als Reaktion auf Calciumionen und CaM zu . Darüber hinaus lokalisiert AKT PtdIns-3Ps in der Postsynapse, die Andockproteine wie tSNARE und Vam7 rekrutiert. Dies führt direkt zum Andocken von AMPA in der Postsynapse. mTOR aktivierte p70S6K und inaktivierte 4EBP1, was die Genexpression verändert, um das Auftreten von LTP zu ermöglichen. Das langfristige Angstkonditionierungstraining war bei Ratten betroffen, aber es gab keine Wirkung bei der kurzfristigen Konditionierung. Insbesondere ging die Amygdala-Angstkonditionierung verloren. Dies ist eine Art von Spurenkonditionierung, die eine Form des Lernens ist, die die Assoziation eines konditionierten Stimulus mit einem unkonditionierten Stimulus erfordert. Dieser Effekt ging bei PI3K-Knockdowns verloren und wurde bei PI3K-Überexpressionen verstärkt.
Rolle beim Gehirnwachstum
Zusätzlich zu seiner oben beschriebenen Rolle bei der synaptischen Plastizität spielt der PI3K-AKT-Signalweg auch eine wichtige Rolle beim Gehirnwachstum, das bei einer Störung des PI3K-Signalwegs verändert wird. Zum Beispiel ist auch das intrakranielle Volumen mit diesem Signalweg verbunden, insbesondere bei AKT3- Intronik-Varianten. Schilddrüsenhormone wurden ursprünglich als primärer Regulator des Gehirnwachstums und der Kognition identifiziert, und neuere Erkenntnisse haben gezeigt, dass Schilddrüsenhormone durch PI3K einige seiner Wirkungen auf die Reifung und Plastizität von Synapsen ausüben.