Eflornithin - Eflornithine
 | |
 | |
| Klinische Daten | |
|---|---|
| Namen austauschen | Vaniqa, andere |
| Andere Namen | α-Difluormethylornithin oder DFMO |
| AHFS / Drugs.com | Monographie |
| Lizenzdaten | |
| Schwangerschaft Kategorie |
|
| Wege Verwaltung |
intravenös , topisch |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | 100 % (intravenös) vernachlässigbar (dermal) |
| Stoffwechsel | Nicht metabolisiert |
| Beseitigung Halbwertszeit | 8 Stunden |
| Ausscheidung | Nieren |
| Bezeichner | |
| |
| CAS-Nummer | |
| PubChem- CID | |
| IUPHAR/BPS | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox-Dashboard ( EPA ) | |
| Chemische und physikalische Daten | |
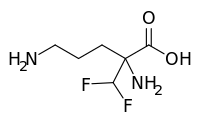
| Formel | C 6 H 12 F 2 N 2 O 2 |
| Molmasse | 182,171 g·mol -1 |
| 3D-Modell ( JSmol ) | |
| |
| |
|
| |
Eflornithin , das unter anderem unter dem Markennamen Vaniqa verkauft wird , ist ein Medikament zur Behandlung der afrikanischen Trypanosomiasis (Schlafkrankheit) und übermäßigem Haarwuchs im Gesicht bei Frauen. Insbesondere wird es für das 2. Stadium der Schlafkrankheit verwendet, die durch T. b. gambiense und kann mit Nifurtimox verwendet werden . Es wird durch Injektion verwendet oder auf die Haut aufgetragen.
Häufige Nebenwirkungen bei der Anwendung als Creme sind Hautausschlag, Rötung und Brennen. Nebenwirkungen der injizierbaren Form sind Knochenmarksuppression , Erbrechen und Krampfanfälle . Es ist unklar, ob die Anwendung während der Schwangerschaft oder Stillzeit sicher ist . Es wird in der Regel für Kinder über 12 Jahren empfohlen.
Eflornithin wurde in den 1970er Jahren entwickelt und kam 1990 in die medizinische Anwendung. Es wurde 2009 in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen, den sichersten und wirksamsten Arzneimitteln, die in einem Gesundheitssystem benötigt werden . In den USA gibt es seit 2015 keine generische Version . In den Vereinigten Staaten ist die injizierbare Form bei den Centers for Disease Control and Prevention erhältlich . In Regionen der Welt, in denen die Krankheit verbreitet ist, wird Eflornithin von der Weltgesundheitsorganisation kostenlos zur Verfügung gestellt .
Medizinische Anwendungen
Schlafkrankheit
Schlafkrankheit oder Trypanosomiasis wird mit Pentamidin oder Suramin (je nach Unterart des Parasiten) behandelt, die in der ersten Phase der Krankheit durch intramuskuläre Injektion verabreicht werden, und mit Melarsoprol und Eflornithin intravenös in der zweiten Phase der Krankheit. Efornithin wird üblicherweise in Kombination mit Nifurtimox verabreicht , wodurch die Behandlungsdauer auf 7 Tage Eflornithin-Infusionen plus 10 Tage orale Nifurtimox-Tabletten verkürzt wird.
Eflornithin ist auch in Kombination mit anderen Medikamenten wie Melarsoprol und Nifurtimox wirksam. Eine Studie aus dem Jahr 2005 verglich die Sicherheit von Eflornithin allein mit Melarsoprol und stellte fest, dass Eflornithin bei der Behandlung der Schlafkrankheit Trypanosoma brucei gambiense im zweiten Stadium wirksamer und sicherer ist . Eflornithin ist bei der Behandlung von Trypanosoma brucei rhodesiense aufgrund der geringen Empfindlichkeit des Parasiten gegenüber dem Arzneimittel nicht wirksam . Stattdessen wird Melarsoprol zur Behandlung von Trypanosoma brucei rhodesiense verwendet . Eine weitere randomisierte Kontrollstudie in Uganda verglich die Wirksamkeit verschiedener Kombinationen dieser Medikamente und stellte fest, dass die Kombination von Nifurtimox und Eflornithin die vielversprechendste Theorie der ersten Wahl war.
In Kongo, Côte d'Ivoire, der Demokratischen Republik Kongo und Uganda wurde eine randomisierte Kontrollstudie durchgeführt, um festzustellen, ob ein 7-tägiges intravenöses Regime für neue und rezidivierende Fälle genauso effizient war wie das standardmäßige 14-tägige Regime. Die Ergebnisse zeigten, dass das verkürzte Regime bei Rückfällen wirksam war, aber dem Standard-Regime für neue Fälle der Krankheit unterlegen war.
Die Nifurtimox-Eflornithin-Kombinationsbehandlung (NECT) ist ein wirksames Regime zur Behandlung der gambiense afrikanischen Trypanosomiasis im zweiten Stadium .
Trypanosomenresistenz
Nach seiner Markteinführung in den 1980er Jahren hat Eflornithin aufgrund seiner geringeren Toxizität für den Wirt Melarsoprol als Medikament der ersten Wahl gegen Human African Trypanosomiasis (HAT) ersetzt. Bereits Mitte der 1980er Jahre wurde über Eflornithin-resistente Trypanosoma brucei berichtet.
Es wird angenommen, dass das Gen TbAAT6, das im Genom von Trypanosomen konserviert ist, für den Transmembrantransporter verantwortlich ist, der Eflornithin in die Zelle bringt. Der Verlust dieses Gens durch spezifische Mutationen führt bei mehreren Trypanosomen zu einer Resistenz gegen Eflornithin. Wird Eflornithin einem Patienten mit humaner afrikanischer Trypanosomiasis verschrieben, die durch ein Trypanosom verursacht wird, das ein mutiertes oder unwirksames TbAAT6-Gen enthält, ist das Medikament gegen die Krankheit unwirksam. Die Resistenz gegen Eflornithin hat die Verwendung von Melarsoprol trotz seiner Toxizität, die mit dem Tod von 5 % der Empfänger von HAT-Patienten in Verbindung gebracht wurde, erhöht.
Übermäßige Gesichtsbehaarung bei Frauen
Die topische Creme ist zur Behandlung von Hirsutismus im Gesicht bei Frauen indiziert . Es ist die einzige topische verschreibungspflichtige Behandlung, die das Wachstum der Gesichtsbehaarung verlangsamt. Es wird zweimal täglich in einer dünnen Schicht aufgetragen, mindestens acht Stunden zwischen den Anwendungen. In klinischen Studien mit Vaniqa zeigten 81 % der Frauen nach zwölfmonatiger Behandlung eine klinische Verbesserung. Positive Ergebnisse wurden nach acht Wochen gesehen. Das Absetzen der Creme führte jedoch innerhalb von 8 Wochen zu einem erneuten Haarwachstum auf das Ausgangsniveau.
Die Behandlung mit Vaniqa reduziert die psychische Belastung durch Hirsutismus im Gesicht deutlich.
Chemo-Präventionstherapie
Es wurde festgestellt, dass Ornithindecarboxylase (ODC) eine hohe Aktivität in Tumorzellen aufweist, was das Zellwachstum und die Zellteilung fördert, während das Fehlen der ODC-Aktivität zu einer Verarmung von Putrescin führt, was zu einer Beeinträchtigung der RNA- und DNA-Synthese führt. Typischerweise werden Medikamente, die das Zellwachstum hemmen, als Kandidaten für die Krebstherapie angesehen, daher wurde Eflornithin natürlicherweise angenommen, dass es einen potentiellen Nutzen als Antikrebsmittel hat. Durch die Hemmung von ODC hemmt Eflornithin das Zellwachstum und die Teilung von sowohl krebsartigen als auch nicht krebsartigen Zellen.
Mehrere klinische Studien zeigten jedoch geringfügige Ergebnisse. Es wurde festgestellt, dass die Hemmung von ODC durch Eflornithin proliferierende Zellen nicht abtötet, was Eflornithin als Chemotherapeutikum unwirksam macht. Die Hemmung der Bildung von Polyaminen durch ODC-Aktivität kann durch diätetische und bakterielle Maßnahmen verbessert werden, da hohe Konzentrationen in Käse, rotem Fleisch und einigen Darmbakterien gefunden werden, die Reserven bereitstellen, wenn ODC gehemmt wird. Obwohl die Rolle von Polyaminen bei der Karzinogenese noch unklar ist, wurde die Polyaminsynthese eher als ursächlicher als als assoziativer Effekt bei Krebs angesehen.
Andere Studien haben gezeigt, dass Eflornithin immer noch in gewisser Weise bei der Chemoprävention helfen kann, indem es die Polyaminspiegel in der kolorektalen Schleimhaut senkt, wobei zusätzliche starke präklinische Beweise für die Anwendung von Eflornithin bei der kolorektalen und Hautkrebsentstehung vorliegen. Dies hat Eflornithin zu einer unterstützten chemopräventiven Therapie speziell für Dickdarmkrebs in Kombination mit anderen Medikamenten gemacht. Mehrere zusätzliche Studien haben ergeben, dass Eflornithin in Kombination mit anderen Verbindungen die Karzinogenkonzentrationen von Ethylnitrosoharnstoff, Dimethylhydrazin, Azoxymethan, Methylnitrosoharnstoff und Hydroxybutylnitrosamin in Gehirn, Rückenmark, Darm, Brustdrüse und Harnblase senkt.
Kontraindikationen
Aktuell
Die topische Anwendung ist bei Patienten mit Überempfindlichkeit gegen Eflornithin oder einen der sonstigen Bestandteile kontraindiziert.
In klinischen Studien zeigen Daten von einer begrenzten Anzahl exponierter Schwangerschaften, dass es keine klinischen Beweise dafür gibt, dass sich die Behandlung mit Vaniqa nachteilig auf schwangere Frauen oder Föten auswirkt.
Mit dem Mund
Bei oraler Einnahme sollte das Nutzen-Risiko-Verhältnis bei Patienten mit eingeschränkter Nierenfunktion oder vorbestehenden hämatologischen Anomalien sowie bei Patienten mit Beeinträchtigung des achten Hirnnervs abgeschätzt werden. Angemessene und gut kontrollierte Studien mit Eflornithin zur Schwangerschaft beim Menschen wurden nicht durchgeführt. Eflornithin sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus überwiegt. Da die afrikanische Trypanosomiasis jedoch unbehandelt eine hohe Sterblichkeitsrate aufweist, kann die Behandlung mit Eflornithin ein potenzielles Risiko für den Fötus rechtfertigen.
Nebenwirkungen
Eflornithin ist nicht genotoxisch; In Kanzerogenitätsstudien, einschließlich einer Photokanzerogenitätsstudie, wurden keine tumorauslösenden Wirkungen beobachtet. Es wurden keine teratogenen Wirkungen festgestellt.
Aktuell
Die topische Form von Elflornithin wird unter dem Markennamen Vaniqa vertrieben. Die am häufigsten berichtete Nebenwirkung ist Akne (7–14%). Andere häufig (> 1 %) berichtete Nebenwirkungen sind Hautprobleme, wie Hautreaktionen durch eingewachsene Haare, Haarausfall, Brennen, Stechen oder Kribbeln, trockene Haut, Juckreiz, Rötung oder Hautausschlag.
Intravenös
Die intravenöse Darreichungsform von Eflornithin wird unter dem Markennamen Ornidyl vertrieben. Die meisten Nebenwirkungen im Zusammenhang mit der systemischen Anwendung durch Injektion sind vorübergehend und durch Absetzen des Arzneimittels oder Verringerung der Dosis reversibel. Hämatologische Anomalien treten häufig auf und reichen von 10 bis 55 %. Diese Anomalien sind dosisabhängig und in der Regel reversibel. Es wird angenommen, dass Thrombozytopenie eher auf einen Produktionsfehler als auf eine periphere Zerstörung zurückzuführen ist. Bei etwa 8 % der Patienten wurden Krampfanfälle beobachtet, die jedoch eher mit dem Krankheitszustand als mit dem Arzneimittel zusammenhängen. Ein reversibler Hörverlust trat bei 30–70% der Patienten auf, die eine Langzeittherapie erhielten (mehr als 4–8 Wochen Therapie oder eine Gesamtdosis von >300 Gramm); zuerst geht das hochfrequente Hören verloren, dann das mittel- und niederfrequente Hören. Da die Behandlung der afrikanischen Trypanosomiasis kurzfristig ist, ist es unwahrscheinlich, dass Patienten einen Hörverlust erleiden.
Interaktionen
Aktuell
Es wurden keine Wechselwirkungsstudien mit der topischen Form durchgeführt.
Wirkmechanismus
Beschreibung
Eflornithin ist ein " Suizid-Inhibitor ", der irreversibel an Ornithin-Decarboxylase (ODC) bindet und verhindert, dass das natürliche Substrat Ornithin das aktive Zentrum erreicht (Abbildung 1). Im aktiven Zentrum von ODC wird Eflornithin mit Hilfe des Cofaktors Pyridoxal-5'-phosphat (PLP) decarboxyliert . Aufgrund seiner zusätzlichen Difluormethylgruppe im Vergleich zu Ornithin kann Eflornithin an einen benachbarten Cys-360-Rest binden und bleibt dauerhaft im aktiven Zentrum fixiert.
Während der Reaktion ist der Decarboxylierungsmechanismus von Eflornithin analog zu dem von Ornithin im aktiven Zentrum, wo eine Transaminierung mit PLP gefolgt von einer Decarboxylierung stattfindet. Im Fall der Decarboxylierung ziehen die an die zusätzliche Methylgruppe gebundenen Fluoridatome die resultierende negative Ladung aus der Freisetzung von Kohlendioxid, wodurch ein Fluoridion freigesetzt wird. Im natürlichen Substrat von ODC nimmt der PLP-Ring die Elektronen auf, die bei der Freisetzung von CO 2 entstehen .
Das verbleibende Fluoridatom , das an die zusätzliche Methylgruppe gebunden ist, erzeugt einen elektrophilen Kohlenstoff, der von der nahegelegenen Thiolgruppe von Cys-360 angegriffen wird, wodurch Eflornithin nach der Freisetzung des zweiten Fluoridatoms und der Transimierung dauerhaft an das Enzym gebunden bleibt.
Beweis
Der Reaktionsmechanismus von Trypanosoma brucei ' s ODC mit Ornithin wurde durch UV-VIS - Spektroskopie charakterisiert , um einzigartige Zwischenprodukte zu identifizieren , die während der Reaktion auftrat. Die spezifische Methode der Multiwellenlängen-Stopp-Flow-Spektroskopie nutzte monochromatisches Licht und Fluoreszenz, um fünf spezifische Zwischenprodukte aufgrund von Änderungen der Absorptionsmessungen zu identifizieren. Die Steady-State-Turnoverzahl k cat von ODC wurde mit 0.5 s −1 bei 4 °C berechnet . Aus dieser Charakterisierung wurde bestimmt, dass der geschwindigkeitsbestimmende Schritt die Freisetzung des Produkts Putrescin aus der Reaktion von ODC mit Ornithin ist. Bei der Untersuchung des hypothetischen Reaktionsmechanismus für Eflornithin, gesammelte Informationen von radioaktivem Peptid und Eflornithin mapping, Hochdruck - Flüssigkeits - Chromatographie , und Peptid - Gasphasensequenzierung vorgeschlagen, Lys-69 und Cys-360 kovalent an Eflornithin in gebundenen T. brucei ODC aktiven Zentrum. Unter Verwendung von Fast-Atom-Bombardment-Massenspektrometrie (FAB-MS) wurde die strukturelle Konformation von Eflornithin nach seiner Wechselwirkung mit ODC als ( S )-((2-(1-Pyrrolin-methyl)-Cystein, ein cyclisches Imin-Addukt) bestimmt dieses speziellen Produkts wurde durch die Möglichkeit unterstützt, das Endprodukt in Gegenwart von NaBH 4 weiter zu ( S )-((2-Pyrrol)methyl) cystein zu reduzieren und das Endprodukt zu ( S )-((2-Pyrrolidin) zu oxidieren ) Methyl) Cystein (Abbildung 2).
Aktive Seite
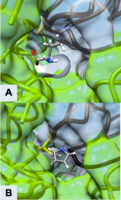
Die Selbstmordhemmung von ODC durch Eflornithin blockiert physikalisch das natürliche Substrat Ornithin vom Zugang zum aktiven Zentrum des Enzyms (Abbildung 3). Es gibt zwei verschiedene aktive Zentren, die durch die Homodimerisierung von Ornithin-Decarboxylase gebildet werden. Die Öffnung zum aktiven Zentrum beträgt ungefähr 13,6 . Wenn diese Öffnungen zum aktiven Zentrum blockiert sind, gibt es keine anderen Wege, durch die Ornithin in das aktive Zentrum eindringen kann. Während des Zwischenstadiums von Eflornithin mit PLP ermöglicht seine Position in der Nähe von Cys-360 eine Interaktion. Da das Phosphat von PLP durch Arg 277 und eine Gly-reiche Schleife (235-237) stabilisiert wird, kann die Difluormethylgruppe von Eflornithin interagieren und vor der Transimierung sowohl an Cys-360 als auch an PLP fixiert bleiben. Wie in der Abbildung gezeigt, stört der Pyrrolinring den Eintritt von Ornithin (Abbildung 4). Eflornithin wird in dieser Position dauerhaft an Cys-360 gebunden bleiben. Da ODC zwei aktive Zentren hat, sind zwei Eflornithin-Moleküle erforderlich, um ODC vollständig von der Ornithin-Decarboxylierung zu hemmen.
Abbildung 3
Aktives Zentrum von ODC, gebildet durch Homodimerisierung (grüne und weiße Oberflächenstrukturen) (A) Ornithin im aktiven Zentrum von ODC, Cys-360 gelb hervorgehoben (B) Produkt der Eflornithin-Decarboxylierung, gebunden an Cys 360 (gelb hervorgehoben). Der Pyrrolinring verhindert, dass Ornithin in das aktive Zentrum eindringt
Geschichte
Eflornithin wurde ursprünglich in den späten 1970er Jahren am Merrell Dow Research Institute zur Krebsbehandlung entwickelt, erwies sich jedoch bei der Behandlung von Malignomen als unwirksam. Es wurde jedoch festgestellt, dass es bei der Reduzierung des Haarwuchses sowie bei der Behandlung der afrikanischen Trypanosomiasis (Schlafkrankheit), insbesondere der westafrikanischen Form (Trypanosoma brucei gambiense), hochwirksam ist.
Hirsutismus
In den 1980er Jahren erhielt Gillette ein Patent für die Entdeckung, dass die topische Anwendung von Eflornithin-HCl-Creme das Haarwachstum hemmt. In den 1990er Jahren führte Gillette Dosierungsstudien mit Eflornithin bei behaarten Frauen durch, die zeigten, dass das Medikament das Wachstum der Gesichtsbehaarung verlangsamt. Gillette meldete daraufhin ein Patent für die Formulierung von Eflornithin-Creme an. Im Juli 2000 bewilligte die US-amerikanische Food and Drug Administration (FDA) einen neuen Arzneimittelantrag für Vaniqa. Im folgenden Jahr erteilte die Europäische Kommission ihre Marktzulassung.
Behandlung der Schlafkrankheit
Das Medikament wurde am 28. November 1990 zur Behandlung der gambiense-Schlafkrankheit zugelassen. 1995 stellte Aventis (heute Sanofi-Aventis) jedoch die Produktion des Medikaments ein, dessen Hauptmarkt afrikanische Länder waren, da es keinen Gewinn erwirtschaftete.
Im Jahr 2001 gingen Aventis und die WHO eine fünfjährige Partnerschaft ein, in deren Verlauf mehr als 320.000 Durchstechflaschen Pentamidin, über 420.000 Durchstechflaschen Melarsoprol und über 200.000 Flaschen Eflornithin von Aventis hergestellt wurden, die an die WHO übergeben und von der Verein Médecins sans Frontières (auch bekannt als Ärzte ohne Grenzen) in Ländern, in denen die Schlafkrankheit endemisch ist.
Laut Médecins sans Frontières geschah dies erst nach "Jahren des internationalen Drucks" und zeitgleich mit der Zeit, in der die Medienaufmerksamkeit durch die Einführung eines anderen Eflornithin-basierten Produkts (Vaniqa, zur Vorbeugung von Gesichtsbehaarung bei Frauen) erregt wurde. , während seine lebensrettende Formulierung (gegen Schlafkrankheit) nicht hergestellt wurde.
Von 2001 (als die Produktion wieder aufgenommen wurde) bis 2006 wurden 14 Millionen Diagnosen gestellt. Dies trug wesentlich dazu bei, die Ausbreitung der Schlafkrankheit einzudämmen und fast 110.000 Menschenleben zu retten.
Gesellschaft und Kultur
Verfügbare Formulare
Vaniqa ist eine Creme, die eine weiße bis cremefarbene Farbe hat. Es wird in Tuben zu 30 g und 60 g in Europa geliefert. Vaniqa enthält 15 Gew.-% Eflornithinhydrochlorid-Monohydrat, entsprechend 11,5% w/w wasserfreiem Eflornithin (EU) bzw. 13,9% w/w wasserfreiem Eflornithinhydrochlorid (US), in einer Creme zur topischen Anwendung.
Ornidyl, zur Injektion bestimmt, wurde in einer Stärke von 200 mg Eflornithinhydrochlorid pro ml geliefert.
Markt
Vaniqa, das unter anderem von der US-amerikanischen FDA sowie von der Europäischen Kommission eine Marktzulassung erhalten hat, ist derzeit das einzige verschreibungspflichtige topische Medikament, das das Wachstum der Gesichtsbehaarung verlangsamt. Abgesehen davon, dass es sich um eine nicht-mechanische und nicht-kosmetische Behandlung handelt, ist es die einzige nicht-hormonelle und nicht-systemische Verschreibungsoption für Frauen, die an Gesichtshirsutismus leiden. Vaniqa wird von Almirall in Europa, SkinMedica in den USA, Triton in Kanada, Medison in Israel und Menarini in Australien vermarktet.
Ornidyl, die injizierbare Form von Eflornithinhydrochlorid, ist von Sanofi-Aventis lizenziert, wird jedoch derzeit in den USA eingestellt.