Durvalumab - Durvalumab
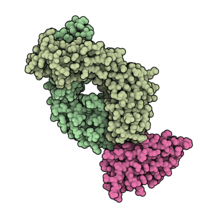
Antigen-bindendes Fragment von Durvalumab (blassgrün) im Komplex mit PD-L1 (rosa). PDB : 5X8M .
| |
| Monoklonaler Antikörper | |
|---|---|
| Typ | Ganzer Antikörper |
| Quelle | Menschlich |
| Ziel | CD274 |
| Klinische Daten | |
| Namen austauschen | Imfinzi |
| Andere Namen | MEDI4736, MEDI-4736 |
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a617030 |
| Lizenzdaten | |
| Schwangerschaft Kategorie |
|
| Wege Verwaltung |
Intravenös |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Identifikatoren | |
| CAS-Nummer | |
| PubChem- CID | |
| IUPHAR/BPS | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Chemische und physikalische Daten | |
| Formel | C 6502 H 10018 N 1742 O 2024 S 42 |
| Molmasse | 146 322 .36 g·mol -1 |
Durvalumab (Handelsname Imfinzi ) ist eine von der FDA zugelassene Immuntherapie gegen Krebs, die von Medimmune / AstraZeneca entwickelt wurde . Es handelt sich um einen monoklonalen Antikörper des humanen Immunglobulin G1 Kappa (IgG1κ), der die Interaktion des programmierten Zelltod-Liganden 1 (PD-L1) mit dem PD-1 (CD279) blockiert.
Durvalumab ist als Checkpoint-Inhibitor- Medikament bekannt.
Medizinische Anwendungen
Die US-amerikanische Food and Drug Administration (FDA) hat Durvalumab für bestimmte Arten von Blasen- und Lungenkrebs zugelassen:
- Erwachsene mit lokal fortgeschrittenem oder metastasiertem Urothelkarzinom, die entweder während oder nach einer platinhaltigen Chemotherapie eine Krankheitsprogression oder innerhalb von 12 Monaten nach einer neoadjuvanten oder adjuvanten Behandlung mit einer platinhaltigen Chemotherapie eine Krankheitsprogression aufweisen.
- Erwachsene mit nicht resezierbarem nicht-kleinzelligem Lungenkrebs im Stadium III, deren Krankheit nach gleichzeitiger platinbasierter Chemotherapie und Strahlentherapie nicht fortgeschritten ist.
- In Kombination mit Etoposid und entweder Carboplatin oder Cisplatin als Erstlinientherapie für Erwachsene mit kleinzelligem Lungenkrebs im extensiven Stadium.
Klinische Versuche
Eine klinische Phase-IB-Studie mit Durvalumab und Tremelimumab zeigte eine gewisse Aktivität bei nicht-kleinzelligem Lungenkrebs (NSCLC). Phase-1-Daten zur fortgeschrittenen metastasierten Urothelblase (Studie 1108) haben zur Zulassung als bahnbrechender Therapie durch die FDA geführt . Erste Ergebnisse einer Phase-I-Studie, in der Durvalumab und Gefitinib bei Lungenkrebspatienten kombiniert wurden, „zeigten sich vielversprechend “. Derzeit läuft eine klinische Phase-I-Studie mit Durvalumab mit einem TLR 7/8-Agonisten (MEDI 9197) bei soliden Tumoren. Derzeit läuft eine Phase 1b/2a-Studie, in der Durvalumab mit einem HPV- DNA-Impfstoff (MEDI 0457) bei Patienten mit HPV-assoziiertem rezidivierendem/metastasierendem Kopf-Hals-Karzinom kombiniert wird .
MYSTIKER
Im Juli 2017 gab AstraZeneca bekannt, dass eine Phase-III-Studie zu Durvalumab mit Tremelimumab als Erstlinienbehandlung von nicht-kleinzelligem Lungenkrebs ihren primären Endpunkt, das progressionsfreie Überleben, nicht erreicht hat.
PAZIFIK
Im November 2017 zeigte die doppelblinde klinische Phase-III-Studie AstraZeneca PACIFIC die Wirksamkeit von Durvalumab bei der Behandlung von nicht-kleinzelligem Lungenkrebs im Stadium III . 709 Patienten mit NSCLC im Stadium III, bei denen nach zwei oder mehr Zyklen einer platinbasierten Chemotherapie keine Krankheitsprogression auftrat, wurden randomisiert Durvalumab oder einem Placebo als Konsolidierungstherapie für ihren Lungenkrebs zugeteilt. Durvalumab verlängerte das mediane progressionsfreie Überleben von 5,6 Monaten (Placebo) auf 16,8 Monate (Durvalumab); die progressionsfreie Überlebensrate nach 12 Monaten wurde von 35,3 % (Placebo) auf 55,9 % (Durvalumab) und die progressionsfreie Überlebensrate nach 18 Monaten von 27,0 % (Placebo) auf 44,2 % (Durvalumab) erhöht. Die mediane Zeit bis zum Tod oder zum Auftreten von Fernmetastasen wurde ebenfalls von 14,6 Monaten (Placebo) auf 23,2 Monate (Durvalumab) verlängert. Extreme Nebenwirkungen wurden ebenfalls von 26,1 % der Patienten (Placebo) auf 29,9 % der Patienten (Durvalumab) erhöht.
KASPIAN
Im März 2021 zeigte die offene, Sponsor-blind (AstraZeneca), randomisierte, kontrollierte Phase-3-Studie an 209 Krebsbehandlungszentren in 23 Ländern weltweit (CASPIAN) die Wirksamkeit von Durvalumab in Kombination mit einer platinbasierten Chemotherapie bei der Behandlung von kleinzelliger Lungenkrebs. Zwischen dem 27. März 2017 und dem 29. Mai 2018 wurden 972 Patienten gescreent und 805 randomisiert (268 wurden Durvalumab plus Tremelimumab plus Platin-Etoposid, 268 Durvalumab plus Platin-Etoposid und 269 Platin-Etoposid zugeteilt). Zum 27.01.2020 betrug die mediane Nachbeobachtungszeit 25,1 Monate (IQR 22,3–27,9). Durvalumab plus Tremelimumab plus Platin-Etoposid war nicht mit einer signifikanten Verbesserung des Gesamtüberlebens im Vergleich zu Platin-Etoposid verbunden (Hazard Ratio [HR] 0,82 [95 % KI 0,68–1,00]; p=0,045); das mediane Gesamtüberleben betrug 10,4 Monate (95% CI 9,6–12,0) gegenüber 10,5 Monaten (9,3–11/2). Durvalumab plus Platin-Etoposid zeigte eine nachhaltige Verbesserung des Gesamtüberlebens gegenüber Platin-Etoposid (HR 0,75 [95 % CI 0,62 – 0,91]; nominal p=0,0032); das mediane Gesamtüberleben betrug 12,9 Monate (95% CI 11,3–14,7) versus 10,5 Monate (9,3–11/2). Die häufigsten unerwünschten Ereignisse vom Grad 3 oder schlimmer waren Neutropenie (85 [32 %] von 266 Patienten in der Durvalumab plus Tremelimumab plus Platin-Etoposid-Gruppe, 64 [24 %] von 265 Patienten in der Durvalumab plus Platin-Etoposid-Gruppe , und 88 [33 %] von 266 Patienten in der Platin-Etoposid-Gruppe) und Anämie (34 [13 %], 24 [9 %] und 48 [18 %]). Schwerwiegende unerwünschte Ereignisse jeglicher Ursache wurden bei 121 (45 %) Patienten in der Durvalumab plus Tremelimumab plus Platin-Etoposid-Gruppe, 85 (32 %) in der Durvalumab plus Platin-Etoposid-Gruppe und 97 (36 %) in der Platin-Etoposid-Gruppe berichtet. Etoposid-Gruppe. Behandlungsbedingte Todesfälle traten bei 12 (5 %) Patienten in der Durvalumab plus Tremelimumab plus Platin-Etoposid-Gruppe auf (Tod, febrile Neutropenie und Lungenembolie [jeweils n=2]); Enterokolitis, allgemeine Verschlechterung der körperlichen Gesundheit und multiples Organdysfunktionssyndrom, Pneumonie, Pneumonitis und Hepatitis, Atemversagen und plötzlicher Tod [jeweils n=1]), sechs (2 %) Patienten in der Durvalumab plus Platin-Etoposid-Gruppe (Herzstillstand, Dehydratation, Hepatotoxizität, interstitielle Lungenerkrankung, Panzytopenie und Sepsis [jeweils n=1]) und zwei (1%) in der Platin-Etoposid-Gruppe (Panzytopenie und Thrombozytopenie [jeweils n=1]).
Verweise
Externe Links
- "Durvalumab" . Informationsportal für Arzneimittel . US-amerikanische Nationalbibliothek für Medizin.
- "Durvalumab" . NCI-Drogenwörterbuch . Nationales Krebs Institut.</ref>
- "Durvalumab" . Nationales Krebsinstitut .
